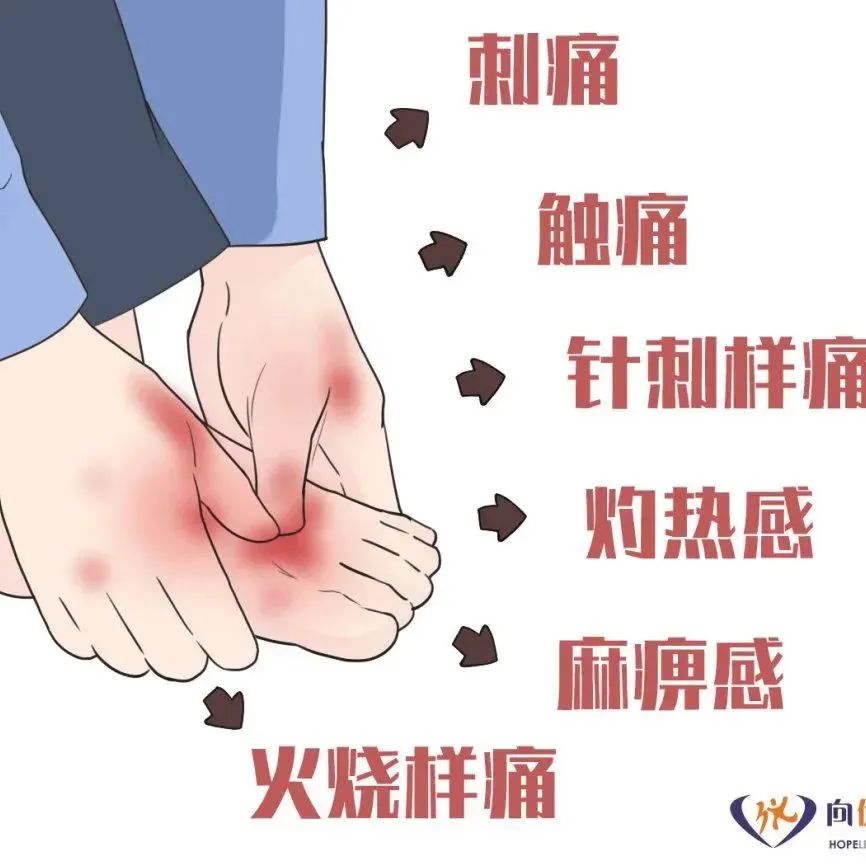
文章来源:翟齐啸,陈卫.膳食模式、肠道菌群与结直肠癌[J].肿瘤代谢与营养电子杂志,2021,4(9):118-127.
结直肠癌是消化系统常见的恶性肿瘤之一,发病概率在所有恶性肿瘤中位居第三[1]。据统计,2012—2015年,我国结直肠癌的 5年相对生存率仅有 52.7%[2]。其病因和发病机制十分复杂,涉及表观遗传突变、炎症与免疫功能、代谢和激素紊乱、氧化应激。环氧化酶?2、核转录因子 NF?κB、TNF?α 和Toll样受体等基因的连续突变积累被认为推动了腺瘤?肿瘤模式恶性进展[3]。这种疾病同时还表现为在恶性和间质细胞之间的炎性细胞浸润。这种炎性症状可受肠道微环境影响,促进肿瘤增殖、转移或抑癌。此外,环境因素可以明显影响结直肠癌的发生发展,但这些因素的作用机制尚不清楚。
近年来,研究发现结直肠癌的发生发展往往伴随着肠道微生物组成的改变[4]。拟杆菌属(Bacteroi?des)、副拟杆菌属(Parabacteroides)、另枝菌属(Alis?tipes)和阿克曼菌属(Akkermansia)[5]等肠道菌群种属丰度的上升可能与结直肠癌的发生呈正相关,而梭菌属(Clostridiales)[5]、双歧杆菌属(Bifidobacteri?um)、乳杆菌属(Lactobacillus)和瘤胃球菌属(Rumi?nococcus)[6]等种属丰度的下降可能进一步加剧结直肠癌。此外,结肠黏膜表面微生物生物膜的形成为结肠细胞的癌变创造了有利条件[7],并与散发性结直肠癌风险的增加相关[8, 9]。在动物模型中,具核梭杆菌、产肠毒素脆弱拟杆菌[10]、致病性大肠埃希菌[11]等特定微生物可能诱导结直肠癌产生[12]。而靶向调控特定肠道微生物或肠道菌群组成可以影响直结肠癌的进程[13, 14]。
除肠道微生物外,膳食成分也是影响结直肠癌发病概率的重要因素。高脂、高糖、大量红肉和酒精等膳食成分的摄入可能增加结直肠癌的患病概率[15]。在Web of Science数据库中以“diet(膳食)”和“colorectal cancer(结直肠癌)”为关键词进行检索,可以发现近 5年相关研究的数量显著上升(图 1)。不同膳食条件对肠道菌群组成具有重要影响,然而不同膳食条件下肠道菌群对结直肠癌发病的具体影响机制尚不完全清楚。因此,本文以不同膳食模式和膳食因子为着眼点,分析了近年来不同膳食条件下的肠道菌群对于结直肠癌发病的影响,以期为结直肠癌的研究和治疗提供一定的参考。

1 不同饮食模式下结直肠癌的发生率
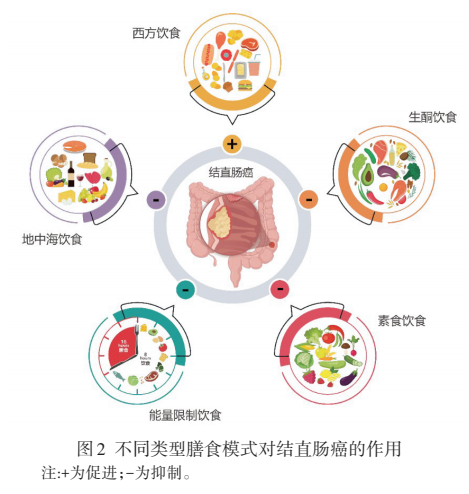
通过分析近年来相关流行病学调查、荟萃分析结果与动物实验数据,可以发现不同饮食模式对结直肠癌发生率存在显著影响(图2)。而部分饮食模式对结直肠癌发生的抑制或促进机制也得到了一定程度的阐释。

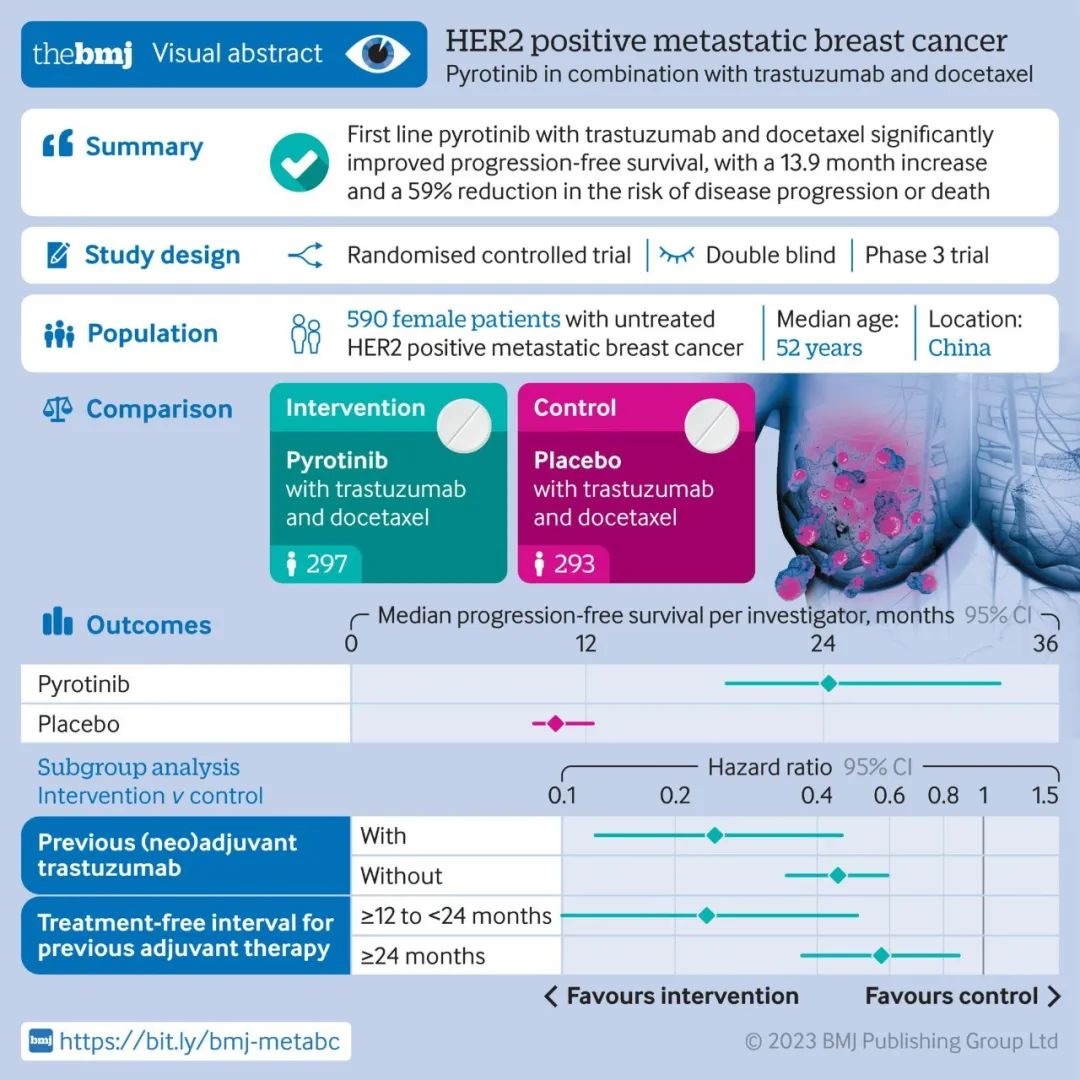
1.1 西方饮食 西方饮食以摄入大量动物肉、加工肉类、高果糖玉米糖浆、精制谷物及高脂乳制品为特点。其膳食营养成分中蛋白、脂肪含量高,而纤维含量少,被认为是一种高糖、高脂、高蛋白、高能量和营养过剩的膳食模式[16]。针对 28 项有关结肠癌与膳食模式之间关系的研究进行荟萃分析,结果表明西方饮食模式下的结直肠癌发生率相对于正常膳食提高了 25%[17]。2018年,一项涉及 2801名参与者的前瞻性队列研究结果表明,结直肠癌患者诊断前的西方饮食评分与全因死亡率呈正相关[18]。而动物模型中,小鼠结直肠切除吻合术后接种肿瘤细胞 CT26,相比于正常膳食,西方膳食模式使小鼠的肿瘤形成率提升了近 60%[19]。这些结果提示,西方膳食模式与结肠癌的发生发展密切相关。此外,研究表明,西方饮食模式中过量的动物性蛋白和脂肪摄入,改变了肠道微生物组成并伴随着肠道内次级胆汁酸和硫化氢的增多,破坏了屏障功能障碍,引发了肠道炎症,增加了结直肠癌的发生风险[20, 21]。
1.2 地中海饮食 地中海饮食泛指处于地中海沿岸南欧各国居民的膳食模式。现阶段,普遍认为地中海饮食是一种较为健康的膳食模式。其以水果、蔬菜、豆类、全谷类、种子和坚果类食物为主,以鱼和橄榄油作为主要的脂肪来源,辅以少量奶制品、红肉和葡萄酒[22]。2020年,Zhong Y 等[23]对 13项前瞻性队列研究的荟萃分析表明,地中海饮食依从性低的受试者结肠癌的发生率比高依从性受试者高13%。Schulpen M 等[24]对 35 372 名中年女性随访17.4 年,发现坚持地中海饮食有助于降低结肠癌的风险。Piazzi G 等[25]以小鼠模型评价了地中海饮食对结直肠癌发生及结肠细胞凋亡的影响,结果表明高脂及低脂饲养的小鼠,在食物中混合 ω?3 多不饱和脂肪酸及多种植物化学成分(模拟地中海饮食),可以显著降低小鼠肿瘤发生率并降低结肠细胞凋亡。这说明,地中海饮食中富含的 ω?3 多不饱和脂肪酸(如二十二碳六烯酸、二十碳五烯酸等)、植物化学成分(如多酚及黄酮类物质等)可以抑制结肠炎症因子的表达,改善和调节肠道微环境,从而降低结直肠癌发生风险[26, 27]。
1.3 禁食 禁食或能量限制饮食(energy restriction,ER)是指在一段时间内完全禁食或限制热量摄入的一种饮食模式。现阶段,报道的禁食模式包括热量限制、间歇性禁食、周期性禁食、模拟禁食饮食和限时进食等。目前,在国际上可检索到两项关于 ER干预缓解结直肠癌的临床研究(NCT00653484,IS?RCTN17994717),但尚不能获得具体实验数据[28, 29]。然而,在其他肿瘤的临床研究中,短期禁食被报道可减轻妇科肿瘤患者化疗的不良反应(如口腔炎、头痛和疲劳),并显著降低血清中肿瘤风险标志物IGF?1 和胰岛素水平[30]。此外,一些动物实验也提供了禁食预防或辅助治疗结直肠癌的证据。雄性SD 大鼠单次注射甲基氧化偶氮甲醇 10 d 后,持续25% 的饮食限制干预可显著减少肠道肿瘤的发生,而模型建立 63 d后进行同样的饮食限制则无效[31]。隔日禁食 2 周则可抑制 CT26 细胞移植小鼠肿瘤的生长,同时降低肿瘤组织中肿瘤相关巨噬细胞 M2极化[32]。禁食引起的代谢变化(如脂肪酸衍生酮体的生成)也被报道对健康有益,包括增加胰岛素敏感性,增加胰岛素敏感性,降低血糖、生长因子信号、炎症、病理性血管生成,并能够抑制氧化应激[33]。ER 则可减少全身葡萄糖和生长因子的生成[34],后者可激活在肿瘤的发展和进展中发挥重要作用的 RAS/MAPK 和 PI3K/AKT两个主要信号级联。同时,禁食也引起抗 Warburg 效应并可促进体外结肠癌模型中肿瘤细胞的凋亡[35]。
1.4 素食饮食 素食饮食是一种限制动物肉及其相关制品摄入的饮食模式[36]。目前,有限的前瞻性研究证明,素食饮食对结直肠癌的预防有积极作用[37?39]。LanouAJ等[40]对2010年以前涉及素食饮食与肿瘤风险的前瞻性研究进行了分析,发现素食能够降低10%~12%的结直肠癌患病风险。而另一项针对6万多人的连续7年跟踪性的前瞻性研究表明:严格的素食者相比非素食者的结直肠癌发病的总体风险较低。特别是在鱼素饮食者(膳食中摄入鱼肉)中,患病风险显著低于非素食饮食[37]。然而,也有研究表明素食饮食与结直肠癌患病风险间的关系是没有显著性的。但半素饮食和鱼素饮食者与非素食者相比,结直肠癌发生风险有显著降低[41]。目前,对于素食饮食降低结直肠癌患病风险的具体机制尚无确切结论。但可以肯定,减少红肉及动物蛋白的摄入,加之素食中含有大量的纤维及植物化学成分,如多酚类物质、胡萝卜素等,可以维持肠道稳态并改善肠道内炎症及氧化应激,从而降低结直肠癌的发病风险[42?44]。
1.5 生酮饮食 生酮饮食是指一类对碳水化合物严格限制的高脂饮食[45],具体表现为高脂肪、充足蛋白质和低碳水化合物的饮食组成。生酮饮食的摄入可以降低和稳定胰岛素水平、轻度升高皮质醇水平和提高脂肪酸氧化,并在一定程度上模拟禁食,进而限制碳水化合物摄入限制癌细胞的能量来源[46]。尽管在流行病学调查和临床试验中,有关生酮饮食与结直肠癌关系的数据仍较为有限,但部分动物实验结果已经有效验证了生酮饮食的潜在保护作用。生酮饮食的摄入可以抑制结肠癌荷瘤小鼠肿瘤的大小及 IL?6的升高,但不会对小鼠体重增加或肌肉质量产生不利影响[47]。此外,生酮饮食通过产生的酮体(三羟基丁酸盐),以 T 细胞依赖性方式抑制了小鼠的抗肿瘤进展,并增强了免疫检查点抑制剂的治疗效果[48]。一项研究给BALB/C裸鼠皮下注射结肠癌细胞 HCT116 后,分别给予正常饮食和生酮饮食,结果发现生酮饮食的摄入可以显著缓解小鼠肿瘤的生长速度、提高小鼠血酮体水平,并降低血胰岛素水平[49]。这些结果为生酮饮食应用于肿瘤患者的治疗提供了较为有力的证据。最新研究也提示了生酮饮食在对肿瘤的辅助治疗以及长期应用方面的潜力[50, 51]。Hopkins BD等[52]发现生酮饮食可以通过抑制葡萄糖?胰岛素反馈的紊乱,提高 PI3K抑制剂的药效。而靶向抑制 PI3K编码的酶p110α被认为是控制肿瘤的一种有效方法。
2 不同膳食成分对结直肠癌发生的影响
不同膳食模式显著影响着结直肠癌的发生发展。一方面,能量和营养物质的过剩造成了机体代谢负担并引起了细胞内外环境失稳,进一步造成了氧化应激和慢性炎症,钝化了免疫系统的监管功能,最终增加了肿瘤的发生率;另一方面,特定膳食成分的缺失或过剩则可能改变肠道微生物组成(表1)、诱导肿瘤相关微生物丰度升高、造成有毒代谢产物的积累,进而促进结肠炎症和肿瘤的发生。

2.1 脂肪、肠道微生物与结直肠癌 高脂饮食与结直肠癌发生的关联目前已经得到证明[64]。在高脂饮食中,脂肪氧化产物4?羟基戊烯酸和氧化甾醇在细胞中积累,作为信号分子参与了细胞的增殖和存活过程,从而影响了肿瘤的发生发展[65]。此外,高脂饮食导致了小鼠肿瘤组织中棕榈酸水平的显著上升。升高的棕榈酸激活了β2肾上腺素受体,对肿瘤细胞代谢进行了重编程,促进了肿瘤细胞增殖[66]。同时,高脂饮食模式下,核激素受体PPARδ、富含亮氨酸重复单位的G蛋白偶联受体5也被激活,参与了肿瘤干细胞的增殖和自我更新,从而促进肿瘤生成[67, 68]。
高脂饮食也可以显著改变肠道微生物组成。大鼠从低脂肪饮食转向高脂肪饮食后肠道菌群多样性显著降低,厚壁菌门的相对丰度显著增加[69]。当喂食小鼠高脂肪食物时,肠道乳酸菌数量降低,梭菌亚群集XIVa有增加[70]。同时,Wan Y等[71]对志愿者进行不同脂肪含量饮食干预时发现,高脂饮食志愿者肠道内菌群多样性显著较低,另枝菌属与拟杆菌属显著较多,而粪杆菌属显著较少。此外,高脂饮食促进了小鼠胆汁酸的分泌,改变了胆汁酸池从而显著改变了肠道微生物组成。紊乱的肠道微环境和次级胆汁酸,则导致了上皮细胞功能退化与黏膜层损伤,进而提高了小鼠患结直肠癌的风险[72]。
2.2 蛋白、肠道微生物与直结肠癌 动物蛋白质的过量摄入增加了结直肠癌的风险[73, 74]。目前,普遍认同的主要机制是蛋白质在结肠腔发酵过程中产生了具有潜在致癌效力的氮、硫类代谢物[75],或高蛋白饮食的摄入改变了肠道菌群的结构和功能,进而影响了结直肠癌的发生和发展[76]。
有趣的是,不同来源的蛋白对肠道微生物组成的影响及在肿瘤发生中的作用是显著不同的。有研究表明,鸡肉蛋白的摄入可以显著提高大鼠肠道中乳杆菌属的丰度,而大豆蛋白则可以提高瘤胃球菌属与拟杆菌属的丰度,并降低乳杆菌属的相对丰度[77, 78]。鱼肉的摄入更能够预防结直肠癌的发生,而红肉摄入则增加了结直肠癌发生的风险[79]。可能的原因包括以下两点:一是红肉多环芳烃和杂环芳族胺的存在具有致癌性,二是血红素能够促进致癌性N?亚硝基化合物的形成和脂质过氧化作用[80]。
2.3 碳水化合物、肠道微生物与结直肠癌 碳水化合物与肿瘤发生发展之间的相关性取决于摄入糖的数量、结构及类型等。目前,较多的研究认为,简单碳水化合物,如葡萄糖、果糖、蔗糖等的过量摄入会加剧肿瘤的发生和发展。而过多的简单多糖摄入可通过激活胰岛素-胰岛素样生长因子?1轴或直接参与有氧糖酵解途径促进结直肠癌的发生发展。摄入复杂碳水化合物,如膳食纤维,则可以显著降低肿瘤发病风险。美国癌症研究所和世界癌症研究基金会将纤维素列为结直肠癌发生的影响因素之一,并认为每天摄入10g膳食纤维即可达到降低10%结直肠癌发病率的效果[81]。而欧洲一项涉及3789例结直肠癌患者的大型前瞻性流行病学研究结果同样表明,膳食纤维的摄入与大肠癌的发病率呈负相关,且与膳食纤维的来源无关[82]。膳食纤维的摄入可以增加排便次数及排便量,减少粪便在肠道中的停留时间,从而避免肠腔与致癌物质的长时间接触[83]。
人体摄入的大量营养物质在小肠中被吸收,而不能被直接吸收利用的大分子碳水化合物则会进入结肠被肠道菌群加以利用[84]。肠道菌群对复杂碳水化合物进行发酵后,肠道菌群产生大量短链脂肪酸对人体健康进行调控,而高水平的短链脂肪酸与结直肠癌的患病概率呈显著的负相关[85]。其中,丁酸可诱导结肠细胞凋亡,通过阻断组蛋白去乙酰化酶调控基因表达,抑制结肠癌细胞增生[86],并通过cAMP依赖的机制激活糖异生[87]。除复杂碳水化合物以外,通过结直肠癌小鼠模型及细胞实验验证了甘露糖可以通过下调葡萄糖转运体(GLUT1)从而达到抑制结直肠癌的发生[87]。
2.4 多酚类、肠道微生物与结直肠癌 膳食来源的多酚具有抗癌特性,其作用机制包括了抗增殖、促凋亡、抗炎活性和抑制肿瘤血管生成等作用[88, 89]。多酚化合物可以通过作用于核转录因子?κB、血管内皮生长因子、表皮生长因子、雷帕霉素蛋白信号通路、环氧化酶、5?脂氧合酶与 miR?21 等[90]影响结直肠癌的发生和发展[91]。此外,多酚类化合物还可以调节肠道微生物组成,改善肠道微环境,从而影响疾病进程。临床试验表明,服用多酚类化合物后,志愿者肠道中的双歧杆菌和乳杆菌含量有所增长[92?94]。在结肠炎相关直肠癌的动物模型中发现,中药甘草中提取的类黄酮异甘草素可有效增加小鼠肠道内丁酸球菌、梭状芽孢杆菌和乳球菌的数量[95]。增补食子儿茶素可增加小鼠肠道内乳杆菌、双歧杆菌和乳球菌的相对丰度[96]。此外,补充黑毛豆中提取的花青素可以在一定程度上改善结直肠癌小鼠的肠道菌群紊乱,逆转有益微生物(如真杆菌、乳杆菌)的减少,同时抑制致病微生物(如弯曲杆菌和幽门螺杆菌)的增加[97]。在另一项研究中也发现绿茶的摄入与编码炎症相关途径(包括LPS生物合成)的微生物基因减少有关[98]。这些证据说明,多酚补充剂能够提高常见肠道有益菌的丰度,并降低一些条件致病菌和促炎微生物的丰度,从而起到促进肠道稳态,抵抗疾病引起的肠道微生物组成失调的作用,进而降低结直肠癌发生风险。
2.5 酒精、肠道微生物与直结肠癌 流行病学研究表明,饮酒以剂量依赖的方式增加了结直肠癌的风险。适量饮酒(<30 g/d)与结直肠癌的发病率没有显著相关性。但其他因素,包括地中海饮食、叶酸缺乏和遗传易感性,或可改变这种相关性[99]。葡萄酒、啤酒和烈酒与结直肠癌的患病风险呈正相关[100]。初步研究表明,肠道菌群或许介导了酒精诱导的结直肠癌的发生。长期摄入酒精会导致肠道菌群的结构发生变化,具体表现为拟杆菌和厚壁菌的丰度降低,变形杆菌和放线菌的丰度升高[101]。在酗酒者的肠道中,占主导地位的专性厌氧菌被大量耗尽,取而代之的是耐氧(兼性厌氧)类细菌(如链球菌属和乳杆菌科、肠杆菌科和肠球菌科中的其他次级种类细菌)。肠道菌群的这些结构变化与乙醇诱导的氧化应激和通透性过高有关,进而导致革兰氏阴性细菌表面物质或代谢产物(如内毒素)从肠腔向全身循环系统的转运增加[102]。而戒酒则被报道可以恢复人体的肠道屏障完整性[103]。此外,动物实验表明,长期摄入酒精导致了大鼠与宿主生理相关的多条代谢途径发生变化,包括短链脂肪酸水平的显著降低[104]。而微生物来源的短链脂肪酸可控制炎症和调节T细胞的数量[105]。除结肠和直肠黏膜细胞外,结肠和直肠中的数种需氧菌和兼性厌氧菌也参与了乙醇转化为致癌性的乙醛。乙醛作为高度致癌物,其产生的影响从DNA损伤到维生素、叶酸的降解等。由于目前有关长期摄入酒精对人体肠道微生物影响的研究甚少,需进一步探究来检验上述假设。
2.6 微量元素、肠道微生物与结直肠癌 机体微量元素水平与结直肠癌的发生发展之间存在一定的联系。Sohrabi M 等[106]分析了结直肠癌患者癌变组织与邻近正常组织中的微量元素含量,发现两种组织间锌、铬、铜、铝、铅、锰、锡与铁的含量具有显著差异。Hughes DJ 等[107]通过测量 966例结直肠癌患者以及对应数量健康人的血液硒浓度,发现结直肠癌的患病风险与血液硒元素含量呈负相关。微量元素作为许多结合蛋白、酶、激素及维生素等的组成成分,对蛋白构象和功能、细胞内稳态、酶活性和代谢等起着关键作用。结直肠癌组织中超氧化物歧化酶、谷胱甘肽还原酶和谷胱甘肽过氧化物酶的活性以及脂质过氧化产物的含量与微量元素的浓度有关,这提示微量元素、细胞氧化应激和肿瘤的发生发展之间存在一定的关联性[108]。此外,近期研究表明微量元素能够通过调节肠道微生物结构影响结直肠癌的发生与发展。六价铬暴露能够加重小鼠结直肠癌,并升高小鼠肠道中 Akkermansia 丰度,降低产短链脂肪酸相关种属的丰度[109]。肠道微环境中铁限制是抑制有害致病菌生长的天然壁垒之一,有害微生物进化出了一系列机制与宿主细胞和其他微生物争夺肠道内有限的铁资源。铁缺乏的结直肠癌患者通过口服铁制剂补充铁则可能致使肠道菌群发生显著变化,有害微生物生长,加重疾病进程[110]。因此,微量元素本身及其对肠道微生态平衡的影响,都可能作用于结直肠癌的发生发展。补充微量元素制剂,尤其是铁制剂时,摄入途径及其对肠道菌群的扰动,需要纳入考虑。
3 结直肠癌的膳食干预策略
3.1 结直肠癌的特殊膳食配方 特殊膳食是指为满足某些特殊人群的生理需要,或某些疾病患者的营养需要,按特殊配方而专门加工的食品。目前,针对结直肠癌的特殊膳食更多的停留在理论阶段,缺乏相应的临床研究。Dahham SS等[111]认为针对结直肠癌的特殊膳食应富含蔬菜、水果、油籽、低糖复合碳水化合物、单不饱和及多不饱和脂肪酸和蛋白质类物质。这些物质具有较强的抗氧化活性,能够降低结直肠癌的发生率和死亡率。同时推荐了一种生物活性食品化合物,主要配方为燕麦麸、大豆蛋白和亚麻籽,比例为2∶1∶1[112]。前期研究证明,这种生物活性食品化合物能够降低HIV患者患代谢综合征的风险[113]。胡安然等[114]也提出了一种供大肠肿瘤患者食用的微生态特殊膳食配方,主要以食源性短肽为原料,并包含多种乳杆菌、双歧杆菌和中草药提取物,能辅助提高机体免疫力,起到抗癌抑癌的作用。
3.2 基于菌群调控的结直肠癌个性化营养 越来越多的证据表明,肠道菌群失调与结直肠癌之间存在密切关系,肠道菌群可通过调节肿瘤微环境及炎症反应、分泌代谢产物以调控免疫细胞功能、直接接触并作用于肠道免疫细胞、形成生物膜等方式,介导免疫相关机制导致结直肠癌发生[115, 116]。研究发现,靶向调控特定肠道细菌或肠道菌群的结构组成可以影响结直肠癌的进程[118]。一些靶向肠道菌群的治疗方法,如通过摄入特定膳食配方、益生菌、粪菌移植等方式调控菌群可能是未来治疗结直肠癌的潜在策略[116, 119, 120]。
基于上述对不同饮食、肠道菌群与结直肠癌关系的理解,可以针对结直肠癌制订个性化的饮食干预策略。首先,优化饮食结构中膳食组分的比例,以提高预防或治疗效果。例如,MIND 饮食是一种专门为预防阿尔茨海默而设计的饮食,它整合了地中海饮食和得舒饮食中对大脑有益的饮食成分,经临床研究证实,该饮食模式对阿尔茨海默病具有明显的预防效果[121]。其次,考虑到结直肠癌患者肠道菌群稳态失衡及菌群代谢物的不良变化,一种新兴的饮食策略即菌群导向性饮食似乎是可行的。例如,基于克罗恩病患者和健康个体的肠道菌群宏基因组学和粪便短链脂肪酸数据,借助计算机建模方法并与细菌代谢模型进行整合,用软件进行个体菌群模拟,成功地预测出每例患者独特的短链脂肪酸谱,最终开发出个性化膳食干预方法。例如,补充果胶和不同的聚糖用于改善患者的短链脂肪酸水平[122]。基于结直肠癌患者独特的肠道菌群组成特点,我们提出了一个可能对结肠癌患者具有预防及治疗效果的个性化饮食策略框架(图 3)。然而,仍需要进一步的研究来明确可作为结直肠癌筛查、预后、治疗反应预测的特定肠道细菌、肠道菌群组成及菌群代谢物。同时,对饮食、肠道菌群和结直肠癌之间的相互作用需要进行更深入的研究。