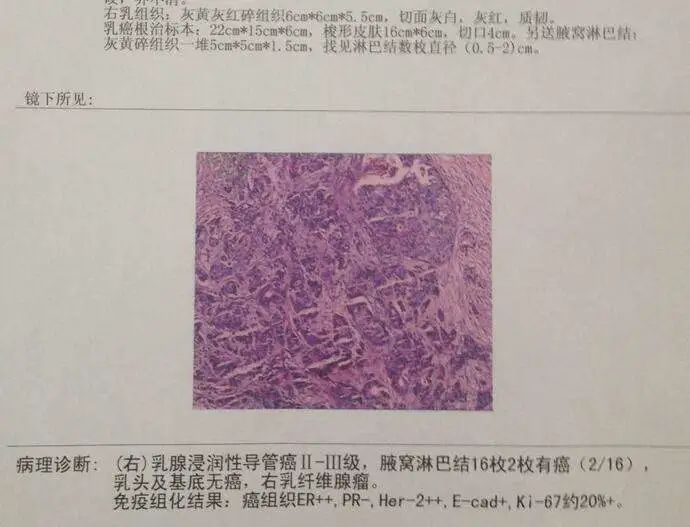
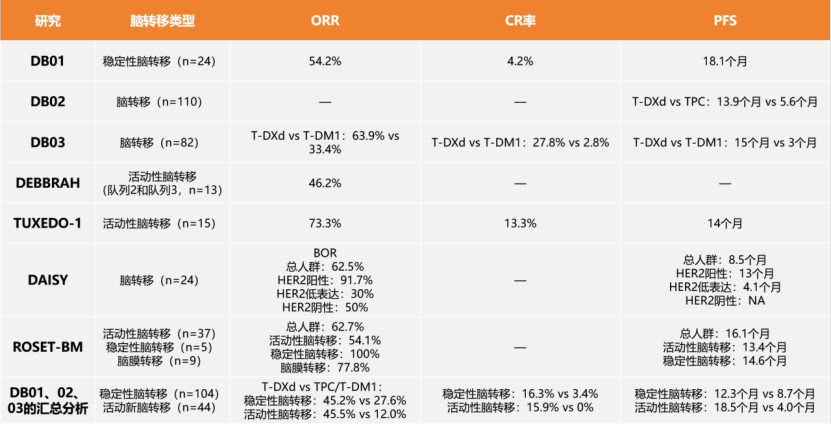
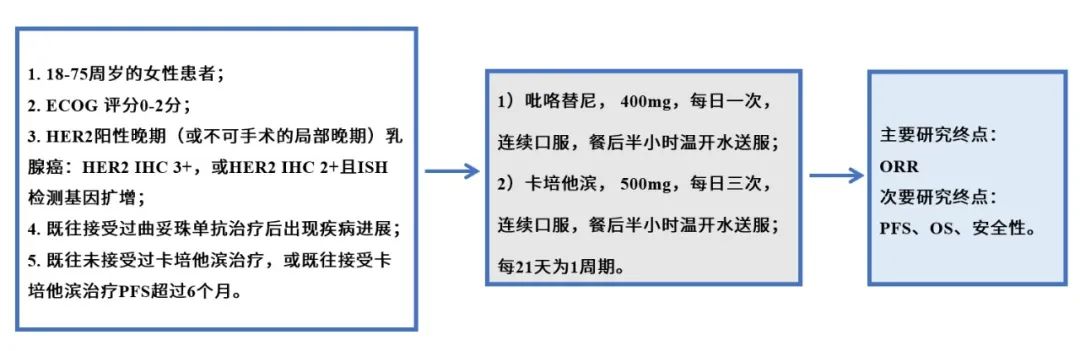
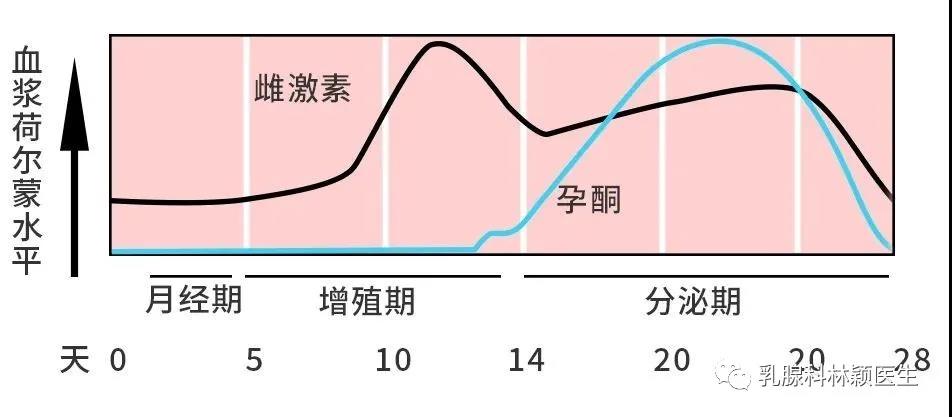
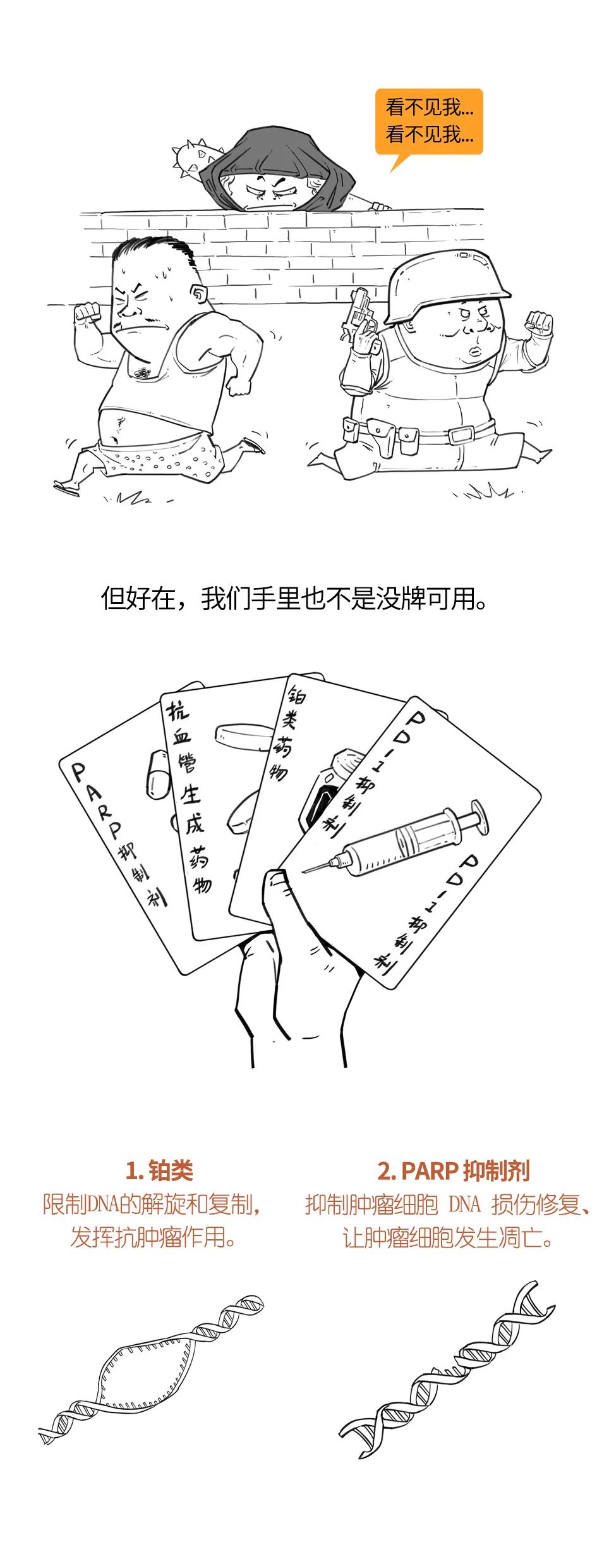
在乳腺癌骨转移患者中,绝大多数为溶骨和混合性转移,而成骨性转移相对少见。
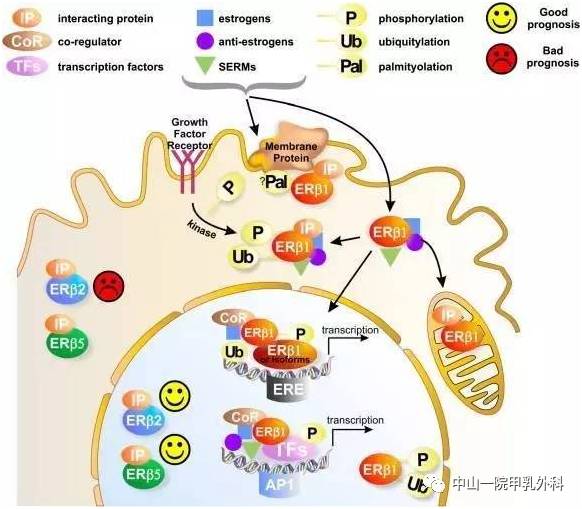
破骨细胞和成骨细胞可以同时激活,解释了骨转移如图可表现为溶骨(骨吸收)、成骨(骨形成)、混合病变。在许多情况下,溶骨和成骨细胞的改变是同时发生的,然而大部分骨转移都表现出破骨细胞的持续激活,因而双膦酸盐和其他破骨细胞抑制剂对大部分类型的骨转移有效。
Fpf帝国网站管理系统
 Fpf帝国网站管理系统
Fpf帝国网站管理系统
Fpf帝国网站管理系统
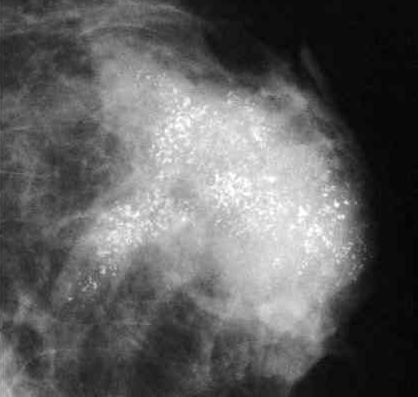
乳腺癌成骨转移基于X线诊断,所以它无法通过骨扫描、磁共振成像和PET检查获得。
虽然CT也是利用X线产生的二维断层图像,但是乳腺癌患者通常从医院得到的只是肺窗、纵隔窗和软组织窗的CT片,无法观察骨转移病变,也无法辨别骨转移的类型。
骨骼的组织密度与其他组织完全不同,必须调整CT的窗宽、窗位,通过骨窗扫描才能显示骨骼的图像和病变。
真正的成骨转移患者,他们没有经历过溶骨性转移,也不伴有内脏或软组织转移的背景。他们经常发生在乳腺癌术后、辅助治疗期间或之后的无病状态。
Fpf帝国网站管理系统
1981年颁布的世界卫生组织(World Health Organization,WHO)骨转移疗效标准。该标准以X线平片作为主要评价手段,认为溶骨性转移病灶治疗后出现钙化是部分缓解(partial response, PR)的表现;而成骨转移则相反,其有效征象是骨质密度的降低。但不管是溶骨还是成骨转移的疾病进展(progressive disease, PD),均表现为原有病灶的扩大和(或)出现新病灶。
骨扫描的使用使药物治疗的评价更加扑朔迷离,因为即使治疗有效,示踪剂的摄取在短期内也可能增加,出现所谓的闪烁现象,误导临床的判断。
骨扫描对骨转移只能起到粗筛的作用,它既不能诊断骨转移,更不能评价药物治疗的效果。
不能将成骨病灶的增多、增大判断是成骨转移患者恶化进展的表现,应当看作是治疗有效的征象。而成骨病灶的骨质密度减低,出现溶骨改变,才是病情恶化的表现,需要启动下一线治疗。
Fpf帝国网站管理系统
肿瘤在骨转移细胞形成之前,通过趋化因子系统、整合素家族以及基质金属蛋白酶家族(MMPs)等众多细胞因子的趋化、侵袭及黏附作用从原发灶部位到达骨组织。肿瘤细胞到达骨组织微环境后,与骨组织各自所分泌的细胞因子相互作用,破坏正常骨组织中成骨细胞/破骨细胞平衡,导致成骨性骨转移。
真正的成骨转移患者,虽然过去没有罹患骨转移的病史,也没有进行PET检查,但在骨骼中肯定存在隐匿病灶,这是成骨转移的起始原点。因为这些患者没有接受过抗乳腺癌治疗,促使这些隐匿病灶一开始就跳过了溶骨破坏的阶段,直接进入稳定修复的成骨状态。
目前,成骨转移机制的研究多集中于前列腺癌。有研究显示,成骨细胞的生长和分化与Cbfa1、Ⅰ型胶原、骨钙素和骨桥蛋白的表达增加相关。骨形成蛋白(bone morphogenetic proteins, BMPs)通过血管内皮生长因子(vascular endothelial growth factor, VEGF)的作用促进成骨细胞活性。前列腺癌细胞可通过诱导内皮细胞转化为成骨细胞促使成骨转移发生。
Fpf帝国网站管理系统
美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)历年发布的指南均没有对乳腺癌骨转移患者进行溶骨和成骨的分组,更没有建议分类处理,只是要求加用双膦酸盐、地舒单抗等骨修饰剂。Fpf帝国网站管理系统
成骨转移无为而治。Fpf帝国网站管理系统
既然患者一开始就出现了成骨修复,那就不要随意打破机体已经建立的平衡,而要尽量延长这种稳定的局面。Fpf帝国网站管理系统
如果HR阳性当然适用内分泌治疗;如果在辅助内分泌治疗阶段出现的成骨转移,则一定继续沿用原来药物治疗;如果HR阴性和(或)人表皮生长因子受体2阳性,只观察不治疗,待出现溶骨转移或内脏转移后,再用化疗和(或)靶向治疗。Fpf帝国网站管理系统
成骨转移的患者一般不存在骨转移相关事件的风险,例如无高钙血症、无骨痛症状、无负重长骨骨折及转移椎体压迫脊髓的可能、无局部放疗和手术的预期,就不必应用双膦酸盐,以免给患者带来肾功能损害和上下颌骨坏死等痛苦。Fpf帝国网站管理系统