近日,中山大学附属第一医院肿瘤介入科李家平教授团队在国际权威期刊Journal of Hepatology(IF=30.083)上发表论文“TREM2+macrophages suppress CD8+T cell infiltration after transarterial chemoembolisation in hepatocellular carcinoma”。oWF帝国网站管理系统
该论文首次揭示了经动脉化疗栓塞术(TACE)术后肝细胞癌(HCC)的独特单细胞免疫微环境景观图谱,并证明了TREM2+肿瘤相关巨噬细胞(TAMs)促进的TACE术后免疫抑制并导致复发转移的机制,提出TREM2或可作为HCC免疫治疗优势靶点的新设想。oWF帝国网站管理系统
 oWF帝国网站管理系统
oWF帝国网站管理系统
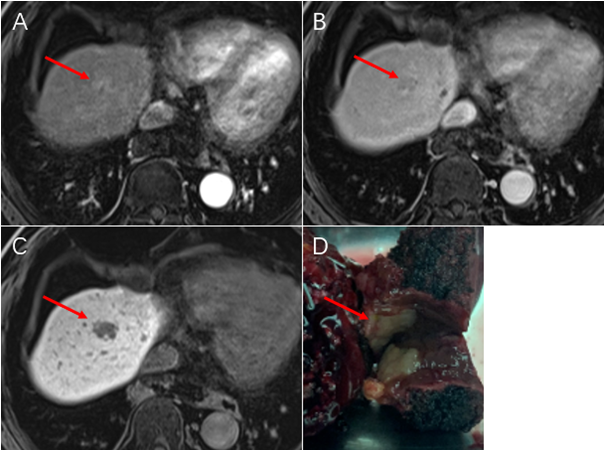
▲经动脉化疗栓塞术(TACE)术后肝细胞癌HCC)的独特单细胞免疫微环境景观图谱oWF帝国网站管理系统
oWF帝国网站管理系统
TACE是针对不可切除肝癌且肝功能良好患者的重要治疗方案。TACE主要是通过阻断肿瘤组织血供、提高局部药物浓度、延长药物作用时间来促使肿瘤变性坏死。但TACE易导致肿瘤微环境缺氧,诱发肿瘤血管新生,并促使肿瘤微环境进入免疫抑制状态,致使残余肿瘤进展,阻碍远期疗效。
为深入探究“TACE术后肝癌免疫微环境变化机制究竟是什么?”这一重大临床科学问题,李家平教授以单细胞转录组学测序等研究手段为突破口,深入研究TACE术后免疫微环境单细胞图谱的变化趋势。
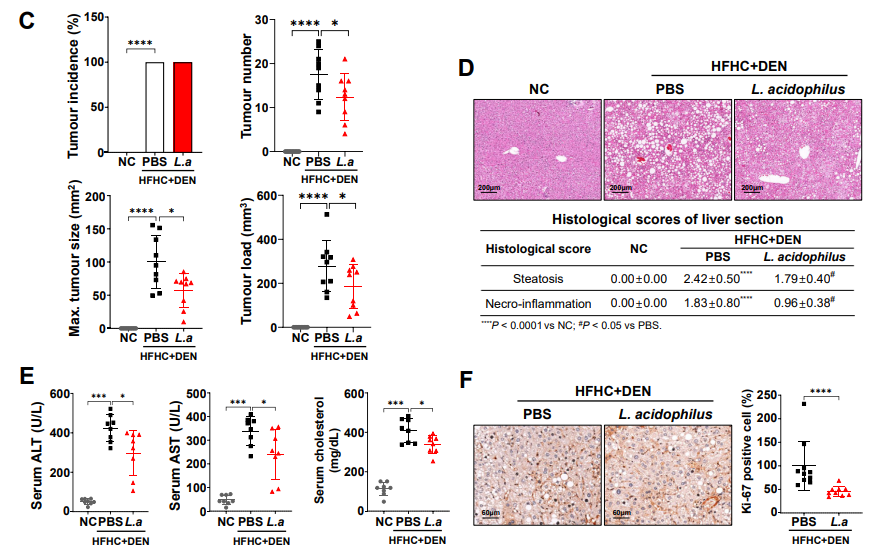
本研究通过收集5例原发初治HCC及5例经TACE治疗降期切除的HCC患者的肿瘤样本,进行单细胞转录组与TCR测序。结果表明:TACE术后免疫微环境中CD8+T及NK细胞数量显著减少,TAMs数量显著增加。TACE术后CD8_C4细胞亚群的比例显著降低,该细胞亚群高度富集了耗竭前期的肿瘤特异性CD8+T细胞。TACE术后TREM2在的TAMs中表达升高,并与不良预后相关。该发现通过多重免疫荧光及流式分析在22例配对的样本中得到验证。与TREM2-TAMs相比,TREM2+TAMs可分泌更低水平的CXCL9,但分泌更高水平的Galectin-1(Gal-1)。体外实验证明:Gal-1可促进了PD-L1在血管内皮细胞中的过表达,并阻碍CD8+T细胞的募集。
为进一步验证其机制,本研究使用TREM2-KO/WT小鼠,采用Hepa1-6 HCC细胞原位注射、高脂饮食联合化学诱导自发性HCC两种小鼠模型进行研究。结果表明:TREM2敲除增加CD8+T细胞的浸润,从而抑制上述两种肝癌模型的肿瘤生长。TREM2敲除增强了抗PD-L1单抗的治疗效果。
本研究表明TREM2+TAMs在抑制CD8+T细胞的浸润和抗肿瘤功能中发挥重要作用。TREM2敲除通过增强CD8+T细胞的抗肿瘤活性协同提升PD-L1单抗的治疗效果。上述发现解释了肝癌TACE治疗后复发和进展的根本原因,并为肝癌TACE治疗后的免疫治疗干预提供了全新的治疗靶点与研究思路。
中山大学附属第一医院博士后谈济洲、副教授范文哲、广东省中医院刘婷助理研究员为文章的共同第一作者,中山大学附属第一医院肿瘤介入科李家平教授为文章的唯一通讯作者。
oWF帝国网站管理系统
论文链接:oWF帝国网站管理系统
https://doi.org/10.1016/j.jhep.2023.02.032oWF帝国网站管理系统