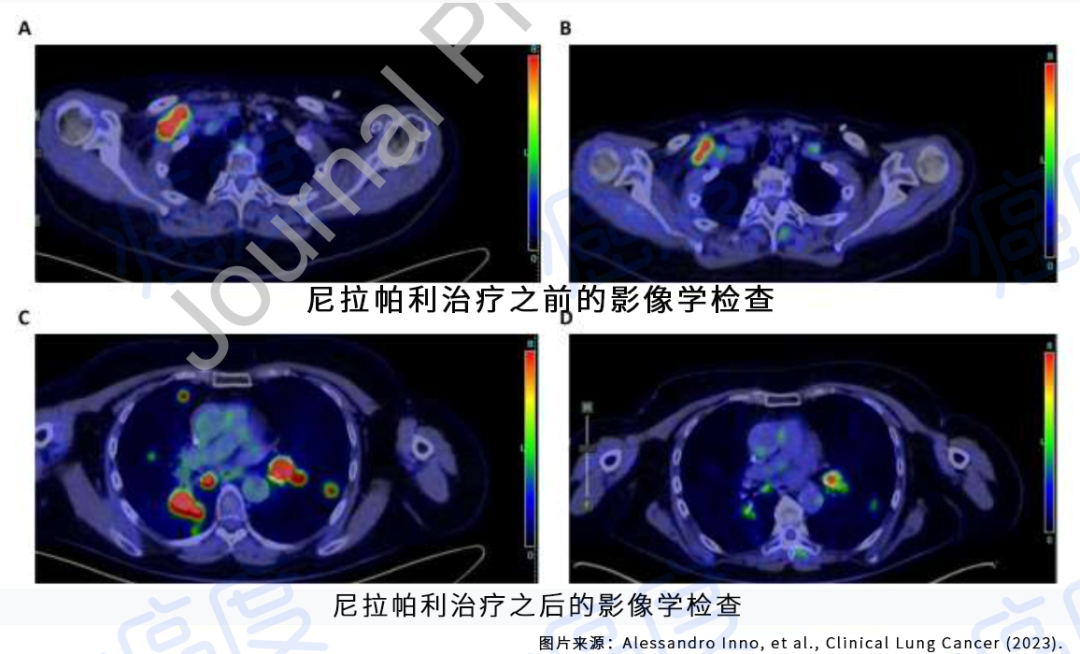
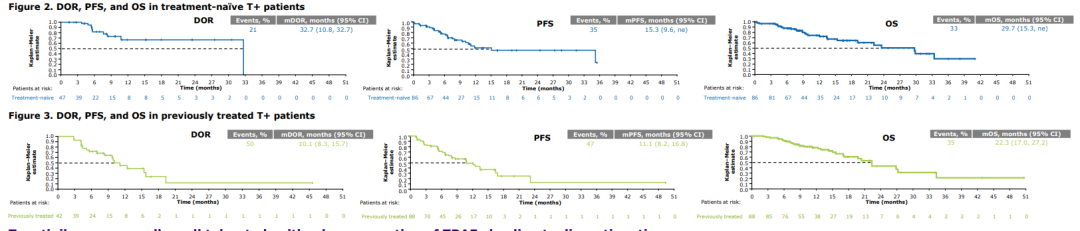
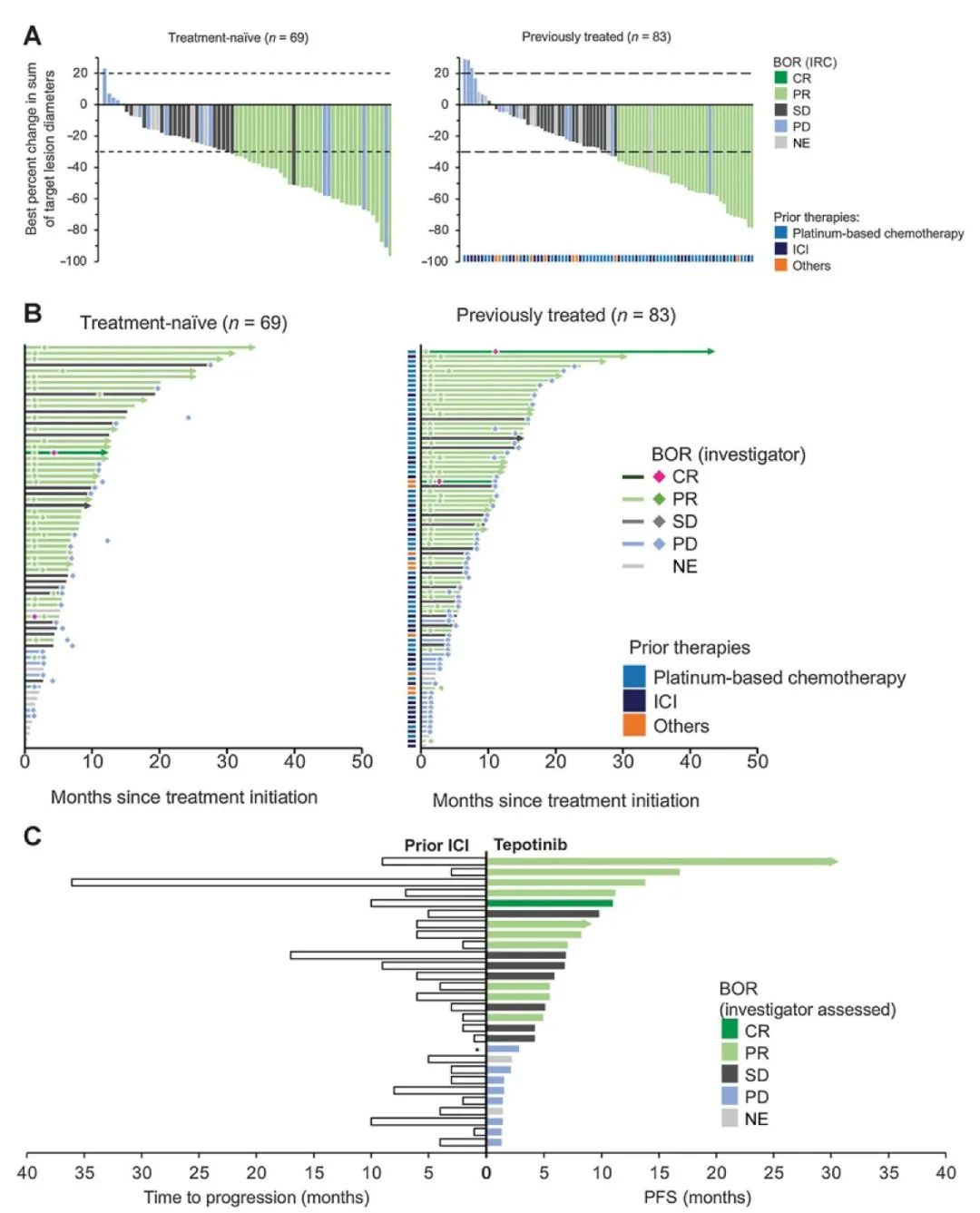
本文目录




a. 多学科评估(包括胸外科医生、胸部放射科医生和肺科医生)共同确定癌症诊断的可能性以及最佳诊断或随访策略。
b. 风险计算可用于对患者个体和放射学因素进行量化,但不能代替拥有肺癌诊断丰富经验的多学科诊断团队的评估。
c. 见诊断评估原则(DIAG-A 1/3)。
d. 最重要的影像学因素是与以前的影像学检查相比结节发生变化还是稳定。


c. 见诊断评估原则(DIAG-A 1/3)。
d. 最重要的影像学因素是与以前的影像学检查相比结节发生变化还是稳定。
e. 低危= 几乎不吸烟或无吸烟史或其他已知危险因素。
f. 高危= 吸烟史或其他已知危险因素。已知的风险因素包括一级亲属有肺癌病史;石棉、氡或铀暴露。
g. 非实性(毛玻璃)结节可能需要更长时间随访,以排除惰性腺癌。
h. 改编自Fleischner学会指南:MacMahon H, NaidichDP, Goo JM, et al. Guidelines formanagement of incidental pulmonary nodules detected on CT images: From the Fleischner Society 2017. Radiology 2017;284:228-243. ©RadiologicalSociety of North America. Fleischner学会指南不指导是否需要对比剂或 LDCT 是否合适。除非需要对比剂强化以获得更好的诊断分辨率,否则首选 LDCT。
i. 颅底至膝关节或全身 PET/CT 检查。PET结果阳性定义为肺结节中的 SUV 大于基线纵 隔血池。PET 扫描结果阳性可以是感染或炎症所致,包括无肺癌的局部感染和肺癌伴相关(如阻塞性)感染,以及肺癌相关炎症(如淋巴结、肺实质、胸膜)。PET 扫描假阴性可以是小结节、低细胞密度(非实性结节或 GGO)或肿瘤的 FDG 亲合性低(如原位腺癌 [ 旧称支气管肺泡癌 ]、类癌)所致。
j. 如果在没有组织确认的情况下考虑进行经验性治疗,需要进行多学科评估,至少包括介入放射学、胸外科和介入性肺病,以确定最安全、最有效的活检方法,或者就活检风 险过高或难度过大以及患者无需组织确认就可以继续治疗的问题达成共识。(IJsseldijk MA, et al. J Thorac Oncol 2019;14:583-595.)
诊断评估的原则(DIAG-A)
1.临床高度怀疑 IA期肺癌的患者(根据危险因素和影像学表现)术前无需活检。

a. 见病理学评估原则 (NSCL-A)。
b. 加强虚弱或老年患者评估可以更好预测各种治疗方式(尤其是手术)后的并发症。尚未建立首选的虚弱评估系统。
c. Temel JS, et al. N Engl J Med 2010;363:733-742
d. 基于胸部 CT:周围型 = 肺的外三分之一;中央型 = 肺的内三分之二。
e. T3N0 与大小或卫星结节有关。
f. 对于通常考虑一种以上治疗模式(手术、放疗或系统性治疗)的患者,应进行多学科综合评估。
、

g. 检查未按优先顺序列出,而是依临床情况、机构程序和对资源的审慎使用而定。
h. 评估方法包括纵隔镜、纵隔切开术、EBUS、EUS 和 CT 引导下活检。对于EBUS-TBNA 阴性的临床(PET 和 / 或 CT)阳性纵隔恶性肿瘤,应在手术切除之前行后续纵隔镜检查。
i. 对于< 3cm的外周肿瘤(肺外三分之一),当CT和PET检查纵膈淋巴结是阴性时,那么纵膈淋巴结转移的可能性较低。因此,在这些情况下进行治疗前纵隔病理学评估并非必需。侵袭性纵隔分期推荐用于中心性肿瘤。
j. 对于医学上不能手术的患者,纵隔活检通常是首选,但在一些选择性的患者中,风险可能大于益处。
k. 颅底至膝关节或全身 PET/CT 检查。对 PET/CT 扫描发现的远处转移需要病理或其他影像学确认。如果 PET/CT 扫描纵隔淋巴结阳性,则该淋巴结情况需要病理学证实。
l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
o. 如果在没有组织确认的情况下考虑进行经验性治疗,需要进行多学科评估,至少包括介入放射学、胸外科和介入性肺科,以确定最安全、最有效的活检方法,或者就活检风险过高或难度过大以及患者无需组织确认就可以继续治疗的问题达成共识。

e. T3N0 与大小或卫星结节有关。
g. 检查未按优先顺序列出,而是依临床情况、机构程序和对资源的审慎使用而定。
h. 评估方法包括纵隔镜、纵隔切开术、EBUS、EUS 和 CT 引导下活检。对于 EBUS-TBNA 阴性的临床(PET和/或 CT)阳性纵隔恶性肿瘤,应在手术切除之前行后续纵隔镜检查。
k. 颅底至膝关节或全身 PET/CT 检查。对 PET/CT 扫描发现的远处转移需要病理或其他影像学确认。如果 PET/CT 扫描纵隔淋巴结阳性,则该淋巴结情况需要病理学证实。
l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
o. 如果在没有组织确认的情况下考虑进行经验性治疗,需要进行多学科评估,至少包括介入放射学、胸外科和介入性肺科,以确定最安全、最有效的活检方法,或者就活检风险过高或难度过大以及患者无需组织确认就可以继续治疗的问题达成共识。
p. 见围手术期全身治疗方案 (NSCL-E)。
q. 如果无法行 MRI,则行头颅增强 CT。
r. 高危因素包括低分化肿瘤(包括肺神经内分泌肿瘤 [ 不包括分化良好的神经内分泌 肿瘤])、血管浸润、楔形切除、脏层胸膜受累和淋巴结状态不明 (Nx)。确定辅助化疗治疗时,这些因素单独一个可能不是指征,但应予考虑。
s. 见同步放化疗方案(NSCL-F)。

m. 见放射治疗原则 (NSCL-C)。
p. 见围手术期全身治疗方案 (NSCL-E)。
s. 见同步放化疗方案(NSCL-F)。
t. R0=无残留肿瘤,R1=显微残留肿瘤,R2=肉眼残留肿瘤。
u. 评估是否需要辅助化疗时,肿瘤增大是重要评估变量。

h. 评估方法包括纵隔镜、纵隔切开术、EBUS、EUS 和 CT 引导下活检。对于 EBUS-TBNA 阴性的临床(PET 和 / 或 CT)阳性纵隔恶性肿瘤,应在手术切除之前行后续纵隔镜检查。
k. 颅底至膝关节或全身 PET/CT 检查。对 PET/CT 扫描发现的远处转移需要病理或其他影像学确认。如果 PET/CT 扫描纵隔淋巴结阳性,则该淋巴结情况需要病理学证实。
p. 见围手术期全身治疗方案 (NSCL-E)。
q. 如果无法行 MRI,则行头颅增强 CT。

l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
p. 见术前系统性治疗方案 (NSCL-E)。
s. 见同步放化疗方案(NSCL-F)。
v. 对于邻近脊柱、锁骨下血管或臂丛神经的肺上沟病变,行脊柱+胸廓入口增强MRI。

l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
p. 见围手术期全身治疗方案 (NSCL-E)。
s. 见同步放化疗方案(NSCL-F)。
t. R0=无残留肿瘤,R1=显微残留肿瘤,R2=肉眼残留肿瘤。

h. 评估方法包括纵隔镜、纵隔切开术、EBUS、EUS 和 CT 引导下活检。对于 EBUS-TBNA 阴性的临床(PET 和 / 或 CT)阳性纵隔恶性肿瘤,应在手术切除之前行后续纵隔镜检查。
k. 颅底至膝关节或全身 PET/CT 检查。对 PET/CT 扫描发现的远处转移需要病理或其他影像学确认。如果 PET/CT 扫描纵隔淋巴结阳性,则该淋巴结情况需要病理学证实。
p. 见围手术期全身治疗方案 (NSCL-E)。
q. 如果无法行 MRI,则行头颅增强 CT。

l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
p. 见围手术期全身治疗方案 (NSCL-E)。
s. 见同步放化疗方案(NSCL-F)。
w. 进行胸部增强CT和/或PET/CT以评估进展。

h. 评估方法包括纵隔镜、纵隔切开术、EBUS、EUS 和 CT 引导下活检。对于 EBUS-TBNA 阴性的临床(PET 和 / 或 CT)阳性纵隔恶性肿瘤,应在手术切除之前行后续纵隔镜检查。
k. 颅底至膝关节或全身 PET/CT 检查。对 PET/CT 扫描发现的远处转移需要病理或其他影像学确认。如果 PET/CT 扫描纵隔淋巴结阳性,则该淋巴结情况需要病理学证实。
l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
p. 见围手术期全身治疗方案 (NSCL-E)。
q. 如果无法行 MRI,则行头颅增强 CT。
s. 见同步放化疗方案(NSCL-F)。
t. R0=无残留肿瘤,R1=显微残留肿瘤,R2=肉眼残留肿瘤。
x. 不同细胞类型(例如鳞状细胞癌、腺癌)的病灶通常是不同原发肿瘤。这种分析可能受到活检样本量较小的限制。但是,同一细胞类型的病灶并不一定是转移灶。单个对侧肺结节的临床、放射学或病理学特征提示为同步原发性肺癌(例如无病生存期长、磨玻璃样成分、组织学特征不同)并能接受局部治疗的,应视为可能的独 立原发癌,且符合局部治疗的条件,见 NSCL-11。多项研究表明,具有广泛基因覆盖的下一代测序 (NGS) 可以清晰地确定不同肺结节之间的克隆相关性。
y. 关于亚实性肺结节的评估、检查和管理指南,见可疑肺癌结节的诊断性评估(DIAG-1)。

l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
z. 多学科评估,包括胸部放射科、呼吸内科、胸外科、肿瘤内科和放射肿瘤科。
aa. 可观察到出现症状风险较低的病变(例如,小的并且生长缓慢的亚实性结节)。然而,如果病变表现出生长加速或实性成分增加或FDG摄取增加,即使是很小的,也应考虑治疗。
bb.首选能保留肺实质的切除术,但应根据肿瘤的分布和机构的专业知识指导个体化治疗。应该对患者进行多学科评估(如外科、放射肿瘤科、肿瘤内科、介入科)。

k. 颅底至膝关节或全身 PET/CT 检查。对 PET/CT 扫描发现的远处转移需要病理或其他影像学确认。如果 PET/CT 扫描纵隔淋巴结阳性,则该淋巴结情况需要病理学证实。
m. 见放射治疗原则 (NSCL-C)。
q. 如果无法行 MRI,则行头颅增强 CT。
s. 见同步放化疗方案(NSCL-F)。

k. 颅底至膝关节或全身 PET/CT 检查。对 PET/CT 扫描发现的远处转移需要病理或其他影像学确认。如果 PET/CT 扫描纵隔淋巴结阳性,则该淋巴结情况需要病理学证实。
m. 见放射治疗原则 (NSCL-C)。
q. 如果无法行 MRI,则行头颅增强 CT。
s. 见同步放化疗方案(NSCL-F)。
cc. 大多数肺癌伴胸膜(心包)积液是由肿瘤所致。但仍有少数患者胸腔积液多次镜 下检查肿瘤细胞均呈阴性,且积液为非血性液,亦非渗出液。当这些因素和临床判 断显示积液与肿瘤无关时,积液不作为分期因素。

k. 颅底至膝关节或全身 PET/CT 检查。对 PET/CT 扫描发现的远处转移需要病理或其他影像学确认。如果 PET/CT 扫描纵隔淋巴结阳性,则该淋巴结情况需要病理学证实。
q. 如果无法行 MRI,则行头颅增强 CT。
dd. 包括选定 M1c 期且转移灶数量和体积有限的患者,这些患者应接受根治性局部治疗。有限数量尚无定论,但临床试验已包括 多达3-5个进展部位。
ee. 见中枢神经系统癌症 NCCN Guidelines。

h. 评估方法包括纵隔镜、纵隔切开术、EBUS、EUS 和 CT 引导下活检。对于 EBUS-TBNA 阴性的临床(PET和/或 CT)阳性纵隔恶性肿瘤,应在手术切除之前行后续纵隔镜检查。
l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
s. 见同步放化疗方案(NSCL-F)。
w. 进行胸部增强 CT 和 / 或 PET/CT 以评估进展。
ff. 通常进行 RT(包括 SABR)或手术切除。影像引导热消融治疗(例如冷冻消融、 微波消融、射频消融)对于未接受 RT 或手术的特定患者可能是一种选择。

q. 如果无法行 MRI,则行头颅增强 CT。
gg. 指南参数中的 CT 扫描时机由临床决策。
hh. 目前,在 NSCLC 患者的常规监测和随访中并不要求 FDG PET/CT。然而,在标准 CT 成像中,很多良性疾病(如肺不张、实变和放射性纤维化)很难与肿瘤区分,这些情况下 FDG PET/CT 可用于区分真正的恶性肿瘤。但是,如果将 FDG PET/CT 作为解决放疗后患者这些问题的工具,则需要组织学证实复发性疾病,因为先前接受 过放疗的区域可保持 FDG 摄取长达 2 年。

l. 见手术治疗原则 (NSCL-B)。
m. 见放射治疗原则 (NSCL-C)。
n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
q. 如果无法行 MRI,则行头颅增强 CT。
s. 联合放疗的化疗方案(NSCL-F)。
ee. 见中枢神经系统癌症 NCCN Guidelines。


a. 见病理学评估原则 (NSCL-A)。
c. Temel JS, et al. N Engl J Med 2010;363:733-742
ii. 如果组织不足,无法进行 EGFR、KRAS、ALK、ROS1、BRAF、NTRK1/2/3、MET、RET和HER2所有检测,则应重复进行活检和/ 或血浆检测。如果这些不可行,则以可获得的结果为指导进行治疗;如果未知,则将这些患者视为无驱动癌基因的患者进行治 疗。
jj. 见分子和生物标志物分析原则 (NSCL-H)。
kk. NCCN NSCLC Guidelines 专家组强烈建议进行更广泛的分子学检测,以确定可能已有有效药物的罕见驱动基因突变,或者适当建议患者参加临床试验。广泛的分子学检测被定义为在单项检测或联合有限数量的检测中,能识别并鉴定“NSCL-19”中的所有生物标志物,以及还能识别新兴生物标志物 (NSCL-I)。鉴于生物标志物同时出现的发生率较低,分层测试方法是可以接受的。广泛的分子谱分析测是改善 NSCLC 患者治疗的关键组成部分。确定患者疗法的新兴生物标志物 (NSCL-I)。
ll. Lam VK, et al. Clin Lung Cancer 2019;20:30-36.e3; Sands JM, et al. Lung Cancer 2020;140:35-41.

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
nn. 适用于体能状态 0-4 的患者。
oo. 贝伐单抗的治疗标准:非鳞状 NSCLC,近期无咯血史。
pp. FDA 批准的生物仿制药是贝伐单抗的合适替代品。
qq. 如果全身治疗方案包含免疫检查点抑制剂,则医生应注意此类药物的半衰期较长以及检查点抑制剂与奥希替尼联合使用或在检查点抑制剂之后使用奥希替尼时报告的不良事件数据。Schoenfeld AJ, et al. Ann Oncol 2019;30:839-844; Oshima Y, et al. JAMA Oncol 2018;4:1112-1115; Oxnard GR, et al. Ann Oncol 2020;31:507-516.

n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
rr. 警惕部分亚群患者在停用EGFR TKI的复燃现象。如果发生疾病复燃,重新启动EGFR TKI。
ss. 临床试验已包括多达3-5个进展部位。
tt. 在进展时考虑进行活检以排除 SCLC 转化(约6%)和评估耐药机制。参见分子和生物标志物分析原则(NSCL-H)。
uu. 阿法替尼 + 西妥昔单抗可用于 EGFR TKI 治疗期间疾病出现进展的患者。
vv. 二线治疗数据表明,对于 EGFR阳性(19del或L858R)、ALK阳性NSCLC 患者,PD-1/PD-L1 抑制剂单药治疗效果不佳,无论 PD-L1 表达如何。

n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
nn. 适用于体能状态 0-4 的患者。
oo. 贝伐单抗的治疗标准:非鳞状 NSCLC,近期无咯血史。
rr. 警惕部分亚群患者在停用EGFR TKI的复燃现象。如果发生疾病复燃,重新启动EGFR TKI。
ss. 有限数量尚无定论,但临床试验已包括 3 至 5 处转移灶。
tt. 在进展时考虑进行活检以排除 SCLC 转化(约6%)和评估耐药机制。参见分子和生物标志物分析原则(NSCL-H)。
uu. 阿法替尼 + 西妥昔单抗可用于 EGFR TKI 治疗期间疾病出现进展的患者。
vv. 二线治疗数据表明,对于 EGFR阳性(19del或L858R)、ALK阳性NSCLC 患者,PD-1/PD-L1 抑制剂单药治疗效果不佳,无论 PD-L1 表达如何。
ww. 在疾病进展时,应考虑基于血浆或组织的广泛分子学检测 以分析T790M 突变和其他基因组耐药机制。如果基于血浆的检测结果阴性,则强烈建议使用重新活检材料进行基于组织的检测。临床医生可能会考虑在推荐血浆检测的同时安排活检。
xx. 对于进行性 CNS 疾病或软脑膜疾病,可考虑使用奥希替尼(无论 T790M 状态如何)。在 Bloom 研究中,对于软脑膜疾病患者而言,奥希替尼的使用剂量为 160 mg。
yy. 在达克替尼的 III 期随机试验中,脑转移患者不符合入组条件。发生脑转移情况下,考虑其他选择。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
nn. 适用于体能状态 0-4 的患者。
qq. 如果全身治疗方案包含免疫检查点抑制剂,则医生应注意此类药物的半衰期较长以及检查点抑制剂与奥希替尼联合使用或在检查点抑制剂之后使用奥希替尼时报告的不良事件数据。Schoenfeld AJ, et al. Ann Oncol 2019;30:839-844; Oshima Y, et al. JAMA Oncol 2018;4:1112-1115; Oxnard GR, et al. Ann Oncol 2020;31:507-516.
jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
zz. 初始治疗期间的监测:应在 2 周期后,然后每 2-4 个周期或有临床指征时使用 CT ± 增强对已知病变部位或高危部位进行疗效评估。指南参数中的 CT 扫描时机由临床决策。
aaa. 通常,在 4 个周期初始全身治疗(即卡铂或顺铂)后进行维持治疗。但是,如果患者对治疗耐受性良好,则可以考虑继续治疗,共 6 个周期。
bbb. 后续治疗期间的监测:每 6-12 周使用 CT ± 增强对已知病变部位或高危部位进行疗效评估。指南参数中的 CT 扫描时机由临床决策。
jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
zz. 初始治疗期间的监测:应在 2 周期后,然后每 2-4 个周期或有临床指征时使用 CT ± 增强对已知病变部位或高危部位进行疗效评估。指南参数中的 CT 扫描时机由临床决策。
aaa. 通常,在 4 个周期初始全身治疗(即卡铂或顺铂)后进行维持治疗。但是,如果患者对治疗耐受性良好,则可以考虑继续治疗,共 6 个周期。
bbb. 后续治疗期间的监测:每 6-12 周使用 CT ± 增强对已知病变部位或高危部位进行疗效评估。指南参数中的 CT 扫描时机由临床决策。
ccc. 如果既往没有使用过KRAS G12C靶向治疗,那么至少可以在一线治疗(或二线及以上)后使用Sotorasib或adagrasib。
ddd. Adagrasib和sotorasib作用机制类似,进展后不建议在这两种药物之间换用。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
nn. 适用于体能状态 0-4 的患者。
n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
rr. 警惕部分亚群患者在停用ALK TKI的复燃现象。如果发生疾病复燃,重新启动ALK TKI。
ss. 临床试验已包括多达3-5个进展部位。
vv. 二线治疗数据表明,对于 EGFR阳性(19del或L858R)、ALK阳性NSCLC 患者,PD-1/PD-L1 抑制剂单药治疗效果不佳,无论 PD-L1 表达如何。
ww. 在疾病进展时,应考虑基于血浆或组织的广泛分子学检测 以分析T790M 突变和其他基因组耐药机制。如果基于血浆的检测结果阴性,则强烈建议使用重新活检材料进行基于组织的检测。临床医生可能会考虑在推荐血浆检测的同时安排活检。

n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
nn. 适用于体能状态 0-4 的患者。
rr. 警惕部分亚群患者在停用ALK TKI的复燃现象。如果发生疾病复燃,重新启动ALK TKI。
ss. 临床试验已包括多达3-5个进展部位。
vv. 二线治疗数据表明,对于 EGFR阳性(19del或L858R)、ALK阳性NSCLC 患者,PD-1/PD-L1 抑制剂单药治疗效果不佳,无论 PD-L1 表达如何。
ww. 在疾病进展时,应考虑基于血浆或组织的广泛分子学检测 以分析T790M 突变和其他基因组耐药机制。如果基于血浆的检测结果阴性,则强烈建议使用重新活检材料进行基于组织的检测。临床医生可能会考虑在推荐血浆检测的同时安排活检。
eee. 无法耐受克唑替尼的患者可改用塞瑞替尼、阿来替尼、布加替尼或劳拉替尼。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
nn. 适用于体能状态 0-4 的患者。
rr. 警惕部分亚群患者在停用ROS1 TKI的复燃现象。如果发生疾病复燃,重新启动ROS1 TKI。
fff. 恩曲替尼可能对脑转移瘤患者有更好的疗效。

n. 影像引导热消融治疗(例如冷冻消融、微波消融、射频消融)对于未接受 SABR 或根治性 RT 的特定患者可能是一种选择。见影像引导热消融治疗原则 (NSCL-D)。
jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
rr. 警惕部分亚群患者在停用R0S1 TKI的复燃现象。如果发生疾病复燃,重新启动ROS1 TKI。
ss. 临床试验已包括多达3-5个进展部位。
ww. 在疾病进展时,应考虑基于血浆或组织的广泛分子学检测 以分析T790M 突变和其他基因组耐药机制。如果基于血浆的检测结果阴性,则强烈建议使用重新活检材料进行基于组织的检测。临床医生可能会考虑在推荐血浆检测的同时安排活检。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)。
nn. 适用于体能状态 0-4 的患者。
ggg. 如果不能耐受“达拉非尼 + 曲美替尼”联合治疗,单药维莫非尼或达拉非尼可作为治疗选择。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)。
nn. 适用于PS评分0-4的患者。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
nn. 适用于PS评分0-4的患者。
rr. 警惕部分亚群患者在停用TKI的复燃现象。如果发生疾病复燃,重新启动TKI。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
nn. 适用于PS评分0-4的患者。
rr. 警惕部分亚群患者在停用TKI的复燃现象。如果发生疾病复燃,重新启动TKI。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
zz. 初始治疗期间的监测:应在 2 周期后,然后每 2-4 个周期或有临床指征时使用 CT ± 增强对已知病变部位或高危部位进行疗效评估。指南参数中的 CT 扫描时机由临床决策。
aaa. 通常,在 4 个周期初始全身治疗(即卡铂或顺铂)后进行维持治疗。但是,如果患者对治疗耐受性良好,则可以考虑继续治疗,共 6 个周期。
bbb. 后续治疗期间的监测:每 6-12 周使用 CT ± 增强对已知病变部位或高危部位进行疗效评估。指南参数中的 CT 扫描时机由临床决策。
ggg. 对于致癌或可能致癌的 HER2 突变,参阅 oncokb.org上的定义。

jj. 参见分子检测和生物标记物分析原则(NSCL-H)。
mm. 参见晚期或转移性疾病的靶向治疗或免疫治疗(NSCL-J)
hhh. PD-1/PD-L1抑制剂治疗的禁忌症可能包括:活动性或既往有记载的自身免疫性疾病,和/或当前正在使用免疫抑制剂,一些致癌驱动基因(例如:EGFR 19缺失或L858R突变,ALK重排)已被证明与 PD-1/PD-L1 抑制剂的获益呈负相关。如果存在禁忌症,请参考NSCL-K 1/5(腺癌)或NSCL-K 2/5(鳞癌)。
iii. 对于需要紧急开始治疗但尚未进行分子学检测的患者,考虑将免疫治疗暂停一个周期,除非确认不存在驱动突变。
jjj. 如果患者没有接受过铂双联化疗,请参考“全身治疗”。如果患者接受了铂化疗和抗pd -1/PD-L1,请参考“后续治疗”。

zz. 初始治疗期间的监测:应在 2 周期后,然后每 2-4 个周期或有临床指征时使用 CT ± 增强对已知病变部位或高危部位进行疗效评估。指南参数中的 CT 扫描时机由临床决策。
aaa. 通常,在 4 个周期初始全身治疗(即卡铂或顺铂)后进行维持治疗。但是,如果患者对治疗耐受性良好,则可以考虑继续治疗,共 6 个周期。
bbb. 后续治疗期间的监测:每 6-12 周使用 CT ± 增强对已知病变部位或高危部位进行疗效评估。指南参数中的 CT 扫描时机由临床决策。