半分钟读全文
三阴性乳腺癌(TNBC),是雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)均不表达的一类乳腺癌,是乳腺癌中最凶险的一种亚型。它极具侵袭性,治疗到复发的时间很短,内脏转移发生率较高,治疗方式又十分有限,所以远期预后比其他乳腺癌类型差很多,一旦出现复发转移,中位生存期不足1年。这个病还有个特点,就是发病年龄往往在40岁以下。著名歌手姚贝娜就因为TNBC病逝,年仅33岁。

2012年的一项研究分析了12,902例提交NCCN中心的乳腺癌病例,发现与ER阳性、PR阳性、HER2阴性的乳腺癌患者相比,TNBC患者中位随访3年时的情况更糟:
大家知道,ER、PR、HER2这3个生物标志物不仅仅是区分乳腺癌类型的标记,更是重要的抗癌靶点。乳腺癌治疗中已得到证实的靶点目前为止只有这3个,因此对TNBC来说,既对最常用的内分泌治疗无效,也无获批的HER2靶向治疗药物可用。不过这三个靶点阴性并不等于没有靶点,科学家们还在努力发掘促发TNBC的其他生物学因素。
就在最近,复旦大学附属肿瘤医院、复旦大学生物医学研究院等机构发现了TNBC可能的新靶点——膜突蛋白(MSN),其研究报告在美国科学促进会《科学》旗下《科学进展》发表。研究发现,TNBC患者与其他亚型乳腺癌患者相比,MSN表达水平显著较高,并且表达水平越高,总生存越差。又发现MSN能够显著刺激体外乳腺癌细胞增殖和浸润以及体内肿瘤生长。其具体机制为蛋白质激酶C将MSN磷酸化,并在细胞核蛋白质NONO的帮助下一起进入细胞核,激活环磷酸腺苷应答元件结合蛋白质(CREP)磷酸化信号传导,进一步促进细胞周期蛋白CCNA1和鸟嘌呤核苷酸交换因子ALS2的信号传导,从而促进乳腺癌的生长、繁殖和浸润。并证实,针对MSN、NONO或CREP的靶向药物可以显著抑制体内乳腺肿瘤生长。给TNBC新药开发提供了新的思路和方向。
那么,对于本文开头那位姑娘的问题,洋葱该怎么回答呢?
Q 我想进一步了解我的基因,有什么样的基因检测可以做?
答:PD-L1检测。
PD-L1阳性的晚期TNBC:
阿替利珠单抗(atezolizumab,曾译为阿特珠单抗)属于备受瞩目的程序性细胞死亡配体1(PD-L1)肿瘤免疫疗法之一,其发挥抗癌作用的机理是利用人体自身的免疫系统来抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡。2019年3月8日,阿替利珠单抗成为首个在美国被批准用于乳腺癌的免疫疗法。其联合化疗用于一线治疗无法切除的局部晚期或转移性PD-L1表达≥1%的三阴性乳腺癌。
阿替利珠单抗联合化疗的组合是基于IMpassion130试验,这是首个使TNBC的中位OS突破两年的III期研究。902例未接受过转移性TNBC治疗的患者随机分为两组,每一组含451位患者(中位随访时间12.9个月),纳入标准不包括BRCA状态。
结果显示,在意向治疗(ITT)人群中,阿替利珠单抗+nab(纳米颗粒白蛋白结合型)紫杉醇组和安慰剂+nab紫杉醇组的中位无进展生存时间(PFS)分别是7.2个月和5.5个月(疾病进展或死亡的HR 0.80,95%CI 0.69-0.92),中位OS分别是21.3个月和17.6个月(死亡HR 0.84,95%CI 0.69-1.02),总体改善并不显著。但在PD-L1阳性的患者中,两组的中位PFS分别为7.5个月和5.0个月(HR 0.62,95%CI 0.49-0.78),中位OS分别为25.0个月和15.5个月(HR 0.62,95%CI 0.45-0.86)。
阿替利珠单抗显著降低了PD-L1阳性的TNBC患者疾病进展和死亡风险,改善了预后,并且没有发现新的不良反应。随访18个月的后续分析证实了PD-L1高表达组中的PFS和OS获益,而PD-L1低表达组缺乏获益。
阿替利珠单抗目前已经批准在中国上市,但尚未获批用于乳腺癌治疗。
Q 根据基因检测结果,还有哪些药物适合我?
答:除了上述的PD-L1,你已经得知BRCA1突变,可尝试PARP抑制剂。
BRCA突变的转移性TNBC:
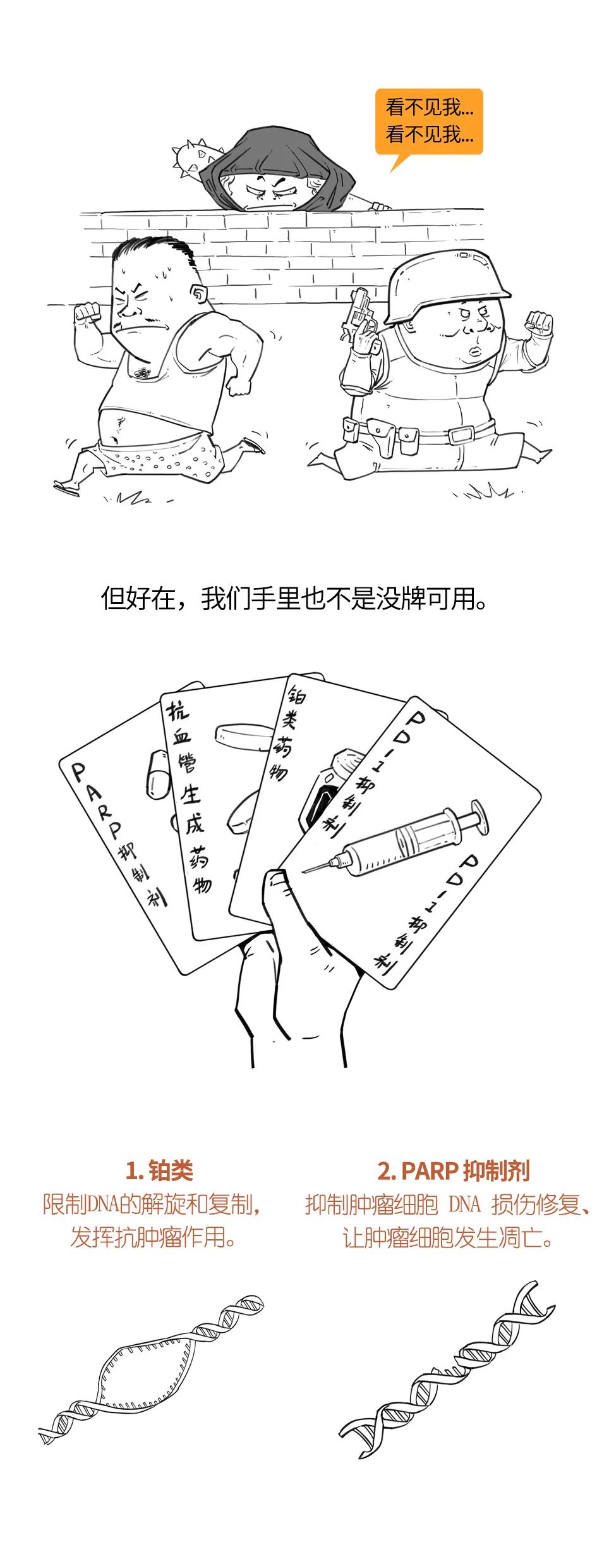
可考虑PARP抑制剂
如果BRCA种系突变的TNBC患者出现复发转移,并且曾接受过新辅助化疗、辅助化疗或转移灶化疗,一般建议其可以口服多腺苷二磷酸核糖聚合酶(PARP)抑制剂,相关研究数据表明,PARP效果更好且副作用较少。
目前已经获批的PARP抑制剂有:奥拉帕尼(用于治疗携带BRCA突变的HER2阴性转移性乳腺癌)和他拉唑帕尼(用于治疗存在有害或疑似有害的生殖系BRCA突变、HER2阴性局部晚期或转移性乳腺癌),两个药均尚未在国内获批用于乳腺癌的治疗。
为什么考虑PARP抑制剂呢?
这里要从BRCA说起
BRCA全名叫乳腺癌易感基因(breast cancer susceptibility gene),是人体内的一种抑癌基因,有BRCA1和BRCA2两种。人体内随时随地都在发生着基因突变,但是因为有BRCA的修复,大部分突变都被修复还原了。如果BRCA自己也突变了,其修复功能就大打折扣,患乳腺癌的概率就大大提高。
携带有BRCA突变的人口约占总人口的0.25%;携带BRCA1突变的女性中55%-65%会在70岁之前患乳腺癌,约45%携带BRCA2突变的女性在70岁之前患乳腺癌。而多达20%的TNBC患者存在BRCA突变,尤其是BRCA1。安吉丽娜朱莉就是因为有遗传性BRCA突变,而预防性切除了乳腺。
PARP是一种广泛存在于人体真核细胞中的多功能蛋白质修饰酶,它与BRCA被称为人体细胞基因稳定的“左右护法”。PARP抑制剂的作用机理是抑制PARP的催化活性,通过“PARP捕获(trapping)”机制,阻碍DNA酶修复已经损伤的DNA。简单来说就是,当BRCA发生突变,正常细胞的DNA修复功能损伤,叛变为癌细胞,导致癌症发生。癌细胞的DNA也会发生损伤,PARP可以帮助其修复,防止DNA彻底崩盘。PARP被抑制后,癌细胞内的基因损伤无法修复,最后只能自毁。
所以BRCA突变的癌细胞比没有突变的正常细胞更离不开PARP,对PARP抑制剂更加敏感。另一方面,PARP抑制剂也不会大片杀死正常细胞,因为它们有正常的BRCA保护。这也保证了这类药物有可控的副作用。
一项随机临床试验入组了302位HER2阴性、BRCA种系突变的转移性乳腺癌患者,结果显示,与化疗组相比,奥拉帕尼(Olaparib)组的PFS延长了将近3个月(7个月 vs 4.2个月),基于此,美国食品和药物管理局(FDA)批准该药用于治疗携带BRCA突变的HER2阴性转移性乳腺癌,也是首个被批准的PARP抑制剂。另一个临床试验OlympiAD将121例携带BRCA突变的转移性TNBC患者随机分入奥拉帕尼组和化疗组,他们均曾在辅助治疗或转移灶治疗中使用过蒽环类+紫杉烷类药物。结果显示,奥拉帕尼组的PFS优于化疗组(疾病进展或死亡的HR 0.43,95%CI 0.29-0.63)。
从这些研究来看,对于BRCA突变的TNBC患者来说,奥拉帕尼是比化疗更好的选择!
QA Q
TNBC的治疗还有哪些新进展?
答:在免疫治疗方面有几个研究非常值得关注。
KEYNOTE-522研究:
针对TNBC新辅助治疗
继IMpassion130研究后,乳腺癌免疫治疗领域另一个重磅突破性研究是KEYNOTE-522研究,这是一项针对TNBC新辅助治疗的随机双盲III期研究。
1174名未接受过治疗的无内脏转移的TNBC患者(根据AJCC分期为T1c N1-2或者T2-4 N0-2) 被随机2:1分为2组,分别给予帕博利珠单抗(pembrolizumab)200mg Q3W或安慰剂,均给予4个周期的紫杉醇+卡铂,然后是4个周期的阿霉素或表柔比星+环磷酰胺的新辅助治疗。在手术后,再接受9个周期的帕博利珠单抗或者安慰剂的辅助治疗,中间如果出现复发或不可接受的副反应则停止。研究的2个首要终点是病理学完全缓解(pCR)和无事件生存期(EFS),pCR定义为ypT0/Tis ypN0(即在乳腺和淋巴结中没有浸润性残留癌)。次要终点包括采用其他定义的pCR,OS及PD-L1阳性患者人群中的有效性、安全性。
2019年欧洲肿瘤医学学会(ESMO)年会上首次公布了这项研究的中期结果。在新辅助治疗期,无论PD-L1表达状态如何,与安慰剂联合化疗相比,帕博利珠单抗联合化疗可以显著提高pCR率(64.8% vs 51.2%,P=0.00055);另一个主要终点EFS的结果分析显示,中位随访15.5个月(2.7-25.0个月),与安慰剂+化疗组相比,帕博利珠单抗+化疗组在EFS方面表现出有利趋势(HR 0.63 [95% CI, 0.43-0.93])。帕博利珠单抗将新辅助期疾病进展和辅助期复发的风险降低了37%,而其安全性与之前的研究一致。在基于PD-L1 表达的pCR探索性亚组分析中,无论PD-L1表达如何,在新辅助化疗中加入帕博利珠单抗均表现出改善。
KEYNOTE-522研究是免疫治疗在乳腺癌新辅助治疗领域的首次成功。更有意义的是,在IMpassion130研究中,患者的OS获益仅在PD-L1阳性患者群体中具有统计学意义,而在KEYNOTE-522研究中,pCR率的获益不受患者PD-L1状态的影响,且EFS的获益也有改善的趋势。
KEYNOTE-355研究:
针对局部复发不可手术的mTNBC
2020年2月12日,默沙东(MSD)宣布帕博利珠单抗联合化疗一线治疗PD-L1阳性的转移性三阴性乳腺癌(mTNBC)患者的关键III期临床试验KEYNOTE-355达到改善患者PFS的主要终点,相比单纯化疗,PFS的改善有统计学意义和临床意义,并且没有出现新的安全问题。数据监测委员会(DMC)对该试验进行了中期分析,建议在既定方案下继续试验,以评估另一个主要终点——OS。
KEYNOTE-355研究是一项随机、分两部分的III期试验。主要评估帕博利珠单抗联合临床医师选择的化疗方案(白蛋白紫杉醇、紫杉醇、吉西他滨/卡铂三种方案中的任意一种)与安慰剂联合化疗用于之前未接受过化疗的局部复发且不适合再进行手术的mTNBC的疗效和安全性差异。我们期待OS的结果。
KEYNOTE-242研究:
针对TNBC的辅助治疗
这是一项评估帕博利珠单抗作为TNBC术后辅助治疗的有效性和安全性的随机III期临床试验,正在进行中,期待帕博利珠单抗有新的里程碑。
针对本文开头那位姑娘的情况,洋葱认为可以考虑以下几点:
1、用手术切除的肿瘤组织进行PD-L1检测。如果免疫组化(IHC)分析显示PD-L1表达≥1%,考虑阿替利珠单抗联合nab紫杉醇进行治疗;如果PD-L1阴性,考虑单药化疗。
2、已知BRCA1突变,并进行了6周期化疗,不清楚是新辅助化疗、辅助化疗亦或是转移灶化疗,若在化疗中发生病情进展,考虑使用PARP抑制剂;若同时PD-L1阳性,也可以考虑阿替利珠单抗联合nab紫杉醇治疗。
3、若未曾在辅助治疗或转移灶治疗中接受过化疗,或者在PARP抑制剂治疗中出现病情进展,则
-
PD-L1阳性,考虑阿替利珠单抗联合nab紫杉醇治疗。
-
PD-L1阴性,考虑使用铂类药物或紫杉烷类药物,具体根据副作用和治疗安排决定。
结语
虽然三阴性乳腺癌是目前最棘手的一类乳腺癌,但是相信随着精准医疗的持续发展,新技术的开发、新药物的发现、新手段的涌现,我们一定会制服这个魔鬼,让三阴性乳腺癌不再是“可怕”和“绝望”的代名词。