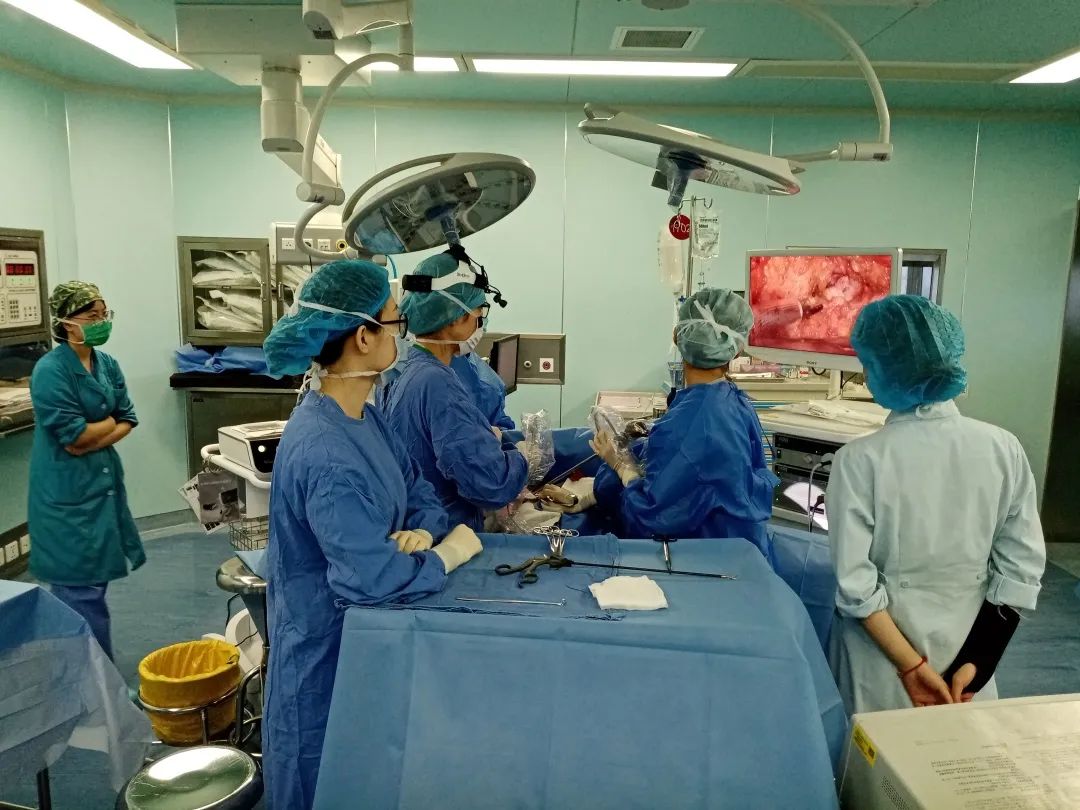
2020年10月6日,国际四大医学期刊之一《美国医学会杂志》正刊发表新闻分析:乳房植入物相关新病例与死亡病例。
2020年8月20日,美国食品药品管理局(FDA)对乳房植入物相关不良事件数据库进行更新:2019年下半年新增160例新病例和3例死亡病例。

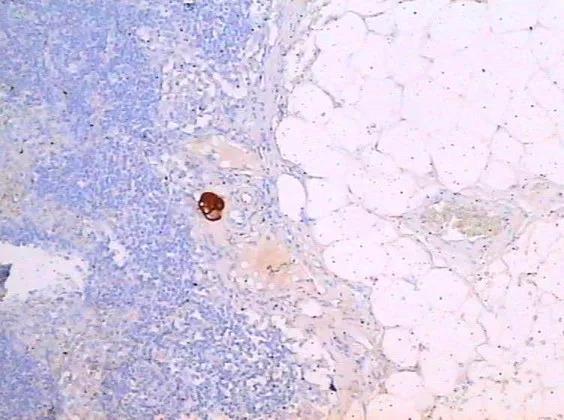
此次更新包括2019年7月7日~2020年1月5日美国和全球医疗机构收到的乳房植入物相关间变性大细胞淋巴瘤报告。2011年,FDA已经确定乳房植入物与间变性大细胞淋巴瘤的潜在关联。5年后,乳房植入物相关间变性大细胞淋巴瘤被世界卫生组织确认为T细胞淋巴瘤,不过由于缺乏病例报告和全球乳房植入物销售数据,故鲜为人知。此后,FDA收到733例乳房植入物相关间变性大细胞淋巴瘤病例报告,其中36例死于该疾病。将近500例患者接受了纹理植入物。
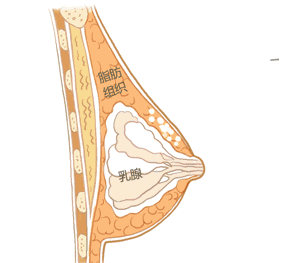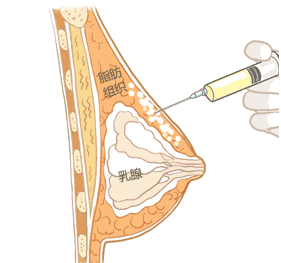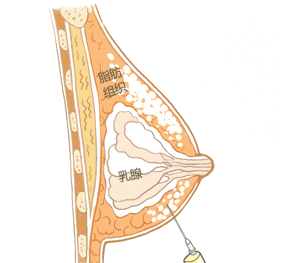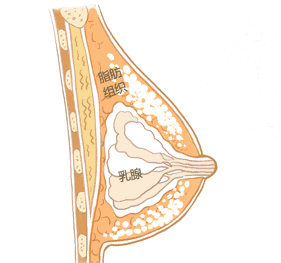
乳房植入物相关间变性大细胞淋巴瘤是一种霍奇金淋巴瘤,大多数情况被发现于植入物附近的瘢痕组织和体液,也可扩散至全身。虽然发生该疾病的可能性极小,但是可致命,尤其如果未能早期诊断或及时治疗。通常可通过手术去除植入物及其周围瘢痕组织,成功地治疗乳房植入物相关间变性大细胞淋巴瘤,但是部分患者需要化疗、放疗或放化疗。
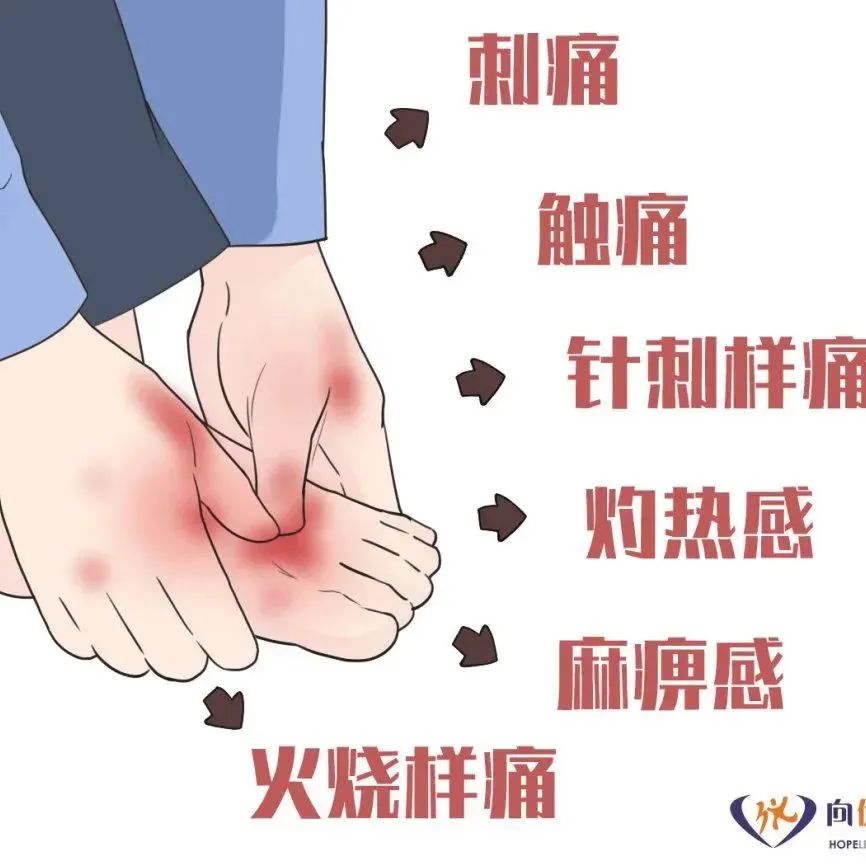
除了乳房植入物相关间变性大细胞淋巴瘤,FDA还收到其他乳房植入物相关症状报告,包括疲劳、记忆力减退、注意力减退、关节疼痛、皮疹。2008年1月~2018年10月,FDA数据显示1080例乳房植入物相关症状报告。不过,接下来的1年内报告数量比前10年增加一倍以上。2018年11月~2019年10月,FDA共收到2497例乳房植入物相关症状报告。
通过医疗器械开发工具(MDDT)计划,FDA还对BREAST-Q乳房重建评分进行了评审。BREAST-Q是一套经过验证的患者自我评分问卷,可对女性的生活质量和乳房重建手术满意度进行量化。研究者和植入物制造商可在获批研究中采用该评分对其产品进行评估。