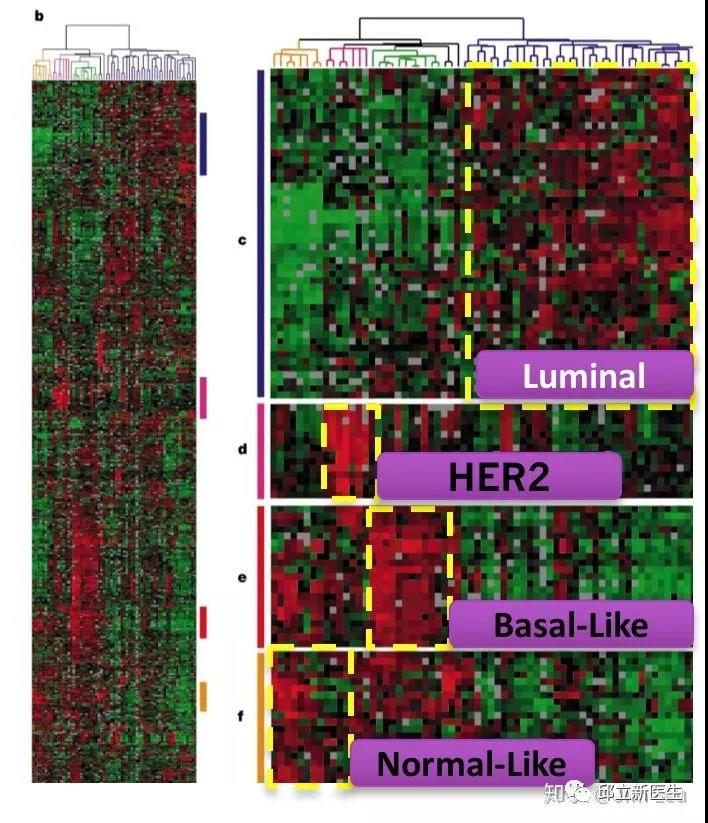
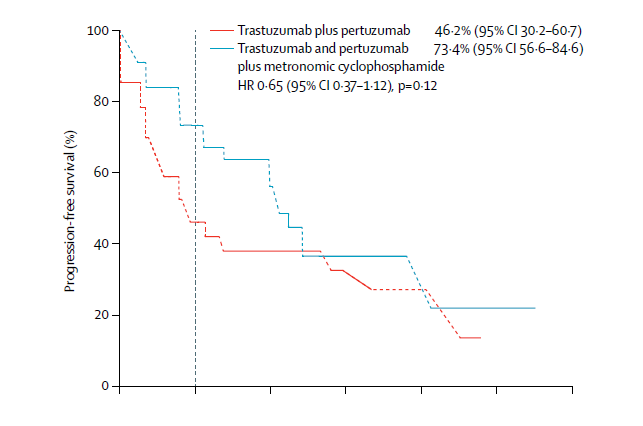
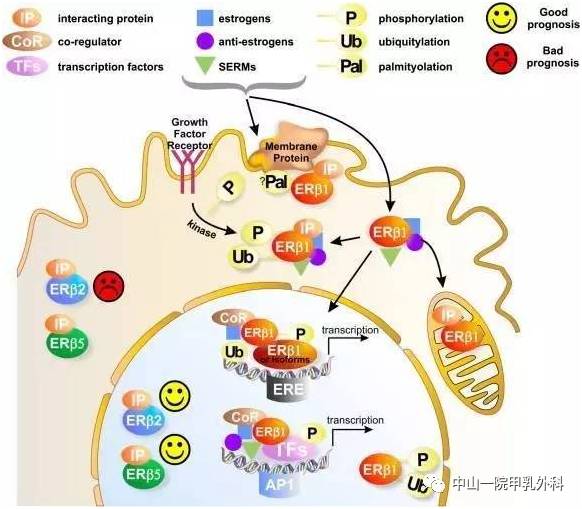
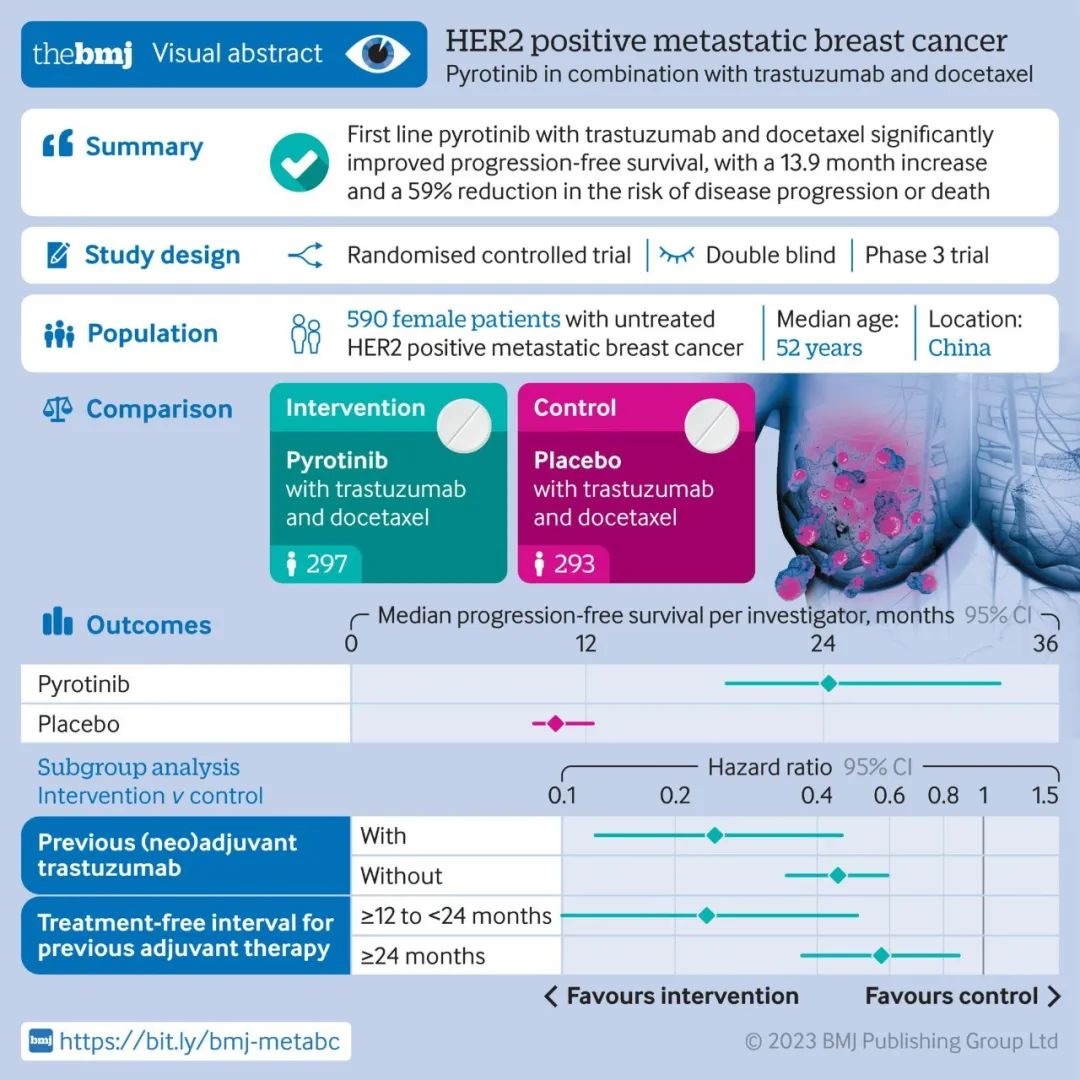
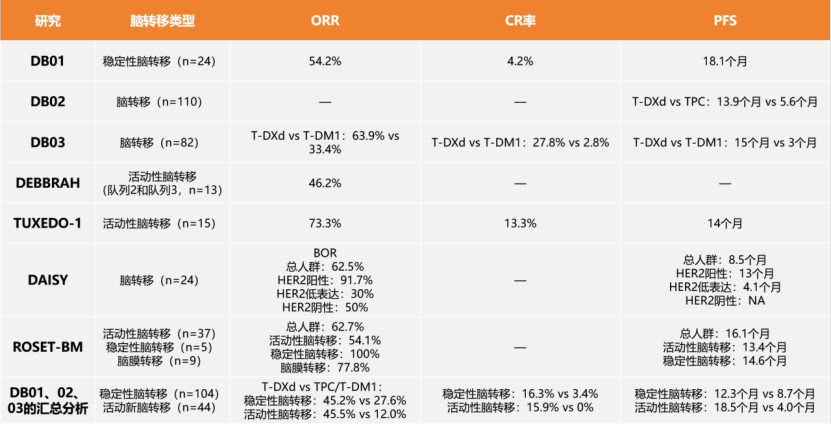
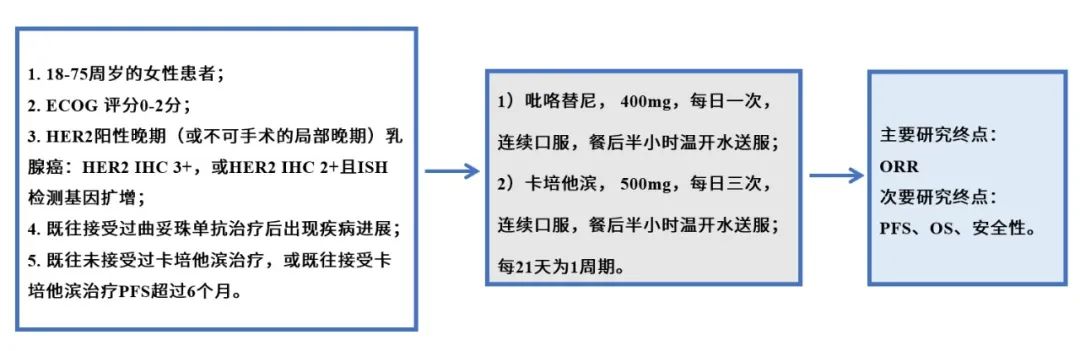
毫不夸张地说,在所有肿瘤中,乳腺癌的治疗与管理是最能体现精准医学的实践,但这也仅仅限于激素受体阳性和人类表皮生长因子受体2(HER2)阳性的肿瘤,因为这两类肿瘤都有了相应的靶向药物。然而,在乳腺癌中,有一个小众类型的癌目前还比较难对付,那就是三阴性乳腺癌(Triple negative breast cancer,TNBC),总体上TNBC侵袭性强,进展快、易复发转移、预后极差。然而,是不是所有表现为TNBC的乳癌都是致命的?或者说患了TNBC就真的绝望了?这篇小文章将来谈谈TNBC的基本诊疗问题。 简单地说:TNBC就是病理诊断中免疫组织化学(Immunohistochemistry, IHC)检测不到雌激素受体(ER)、孕激素受体(PR)和HER2表达的一类乳腺癌,即以上三种蛋白都是阴性。另外还有一些名称可以表达这类乳癌,如基底样型乳腺癌(Basal-like breast cancer),这是需要通过基因表达谱检测并进行聚类后分出的乳腺癌亚型,目前国内各大医院病理科几乎做不到,一是成本高,二是分析上还是有难度。所以临床实践中最为常用的分类手段还是IHC,通常用这几个抗体:ER、PR、HER2,外加Ki67,以明确细胞增殖活力。因此叫IHC-4分类发,这种分类法可以涵盖了基因表达谱分型的中80%-90%的基底样型乳腺癌。对于TNBC,IHC检测常加上表皮生长因子受体(EGFR)和角蛋白5/6(CK5/6)等。乳腺癌的常见类型见下图(图1)。 图1.乳腺癌组织学类型(Cancer Biol Ther. 2010; 10(10): 955–960) 图2. 乳腺癌的分子分型(IHC4法分类)(Arch Pathol Lab Med. 2016;140(8):806-14) 图3. 乳腺癌分子分型(基因表达谱法)(Perou,Nature. 2000 ;406(6797):747-52) 其实,TNBC不是单一的疾病,而是一群疾病的总称,这就是肿瘤的异质性(heterogeneity),这种异质性有宏观上的表现(病理形态学和临床进程),也有微观上的特征(分子水平及其微环境免疫状态等)。因此,诊断与治疗上都需要对TNBC进一步细分,绝不能认为一锅端就能治好TNBC。TNBC常见的组织学类型如下(图4)。其中不同的组织学亚型其生物学行为各异,有高危与低危之分(图中黑色框为低危,红色框代表高危),它们的临床预后各有不同。因此,也不是所有的三阴性乳癌都是致命的。这些亚型各异的TNBC又可以再按其基因表达与突变的不同分为不同的基因亚型,常见的TNBC分子亚型如下(图5)。 图4. 三阴性乳腺癌(TNBC)常见组织学类型(NPJ Breast Cancer. 2016;16;2:16036. Am J Pathol. 2017 ;187(10):2139-2151. Nat Rev Clin Oncol. 2016 13(11):674-690) 图5. 三阴性乳腺癌常见亚型(Clin Cancer Res. 2013;19(23):6380-8. J Clin Invest. 2011 ;121(7):2750-67) 图5关于TNBC的分子分子分型是美国Vanderbilt University( Nashville, Tennessee)医学中心Lehmann等人于2011年根据587例TNBC基因表达谱结果聚类分析后发表的分子分型,包括基底样1型(BL1)、基底样2型(BL2)、免疫调节型(IM)、间充质型(M)、间充质干细胞型(MSL)和管腔雄激素受体型(LAR)及不能分类的TNBC。2019年3月,复旦大学肿瘤医院邵志敏团队通过对465例原发性TNBC样本进行高通量分析,将TNBC分为4个亚型:包括腔面雄激素受体型(LAR)、免疫调节型(IM)、基底样免疫抑制型(BLIM)和间充质型(MES)。尽管Lehmann分型法给临床预后与治疗一些提示如IM亚型预后较好,LAR亚型预后最差;BL1亚型基因组稳定性最差,TP53/ target=_blank class=infotextkey>P53突变率?高及DNA修复相关基因(BRCA2、MDM2、PTEN、RB1&TP53)拷?贝数缺失率?;而LAR亚型肿瘤突变负荷高,以PI3KCA、AKT1和CDH1基因突变最显著;M和MSL亚型?表达血管生成基因标记物。IM?表达免疫相关基因及检查点抑制剂基因如PD1/ target=_blank class=infotextkey>PD1、PDL1及CTLA4。Lehmann等也开发了TNBCtype在线分型工具(http://cbc.mc.vanderbilt.edu/tnbc/),但临床应用仍比较局限,目前国内尚未有类似分型工具。国内刚发表的关于TNBC多组学大数据,分型上与Lehmann分型有重叠,但需要临床进一步验证。 图6. 基于中国人群三阴性乳腺癌基因组数据的TNBC亚型(Cancer Cell. 2019;35(3):428-440) 在谈TNBC精准治疗前,先了解一下TNBC的常规治疗手段,一般手术后再砍向TNBC的三把斧头是:一二三线的化疗、PD-1抑制剂和PARP抑制剂。 国家卫健委2018年关于乳腺癌辅助化疗方案的选择大致如下(参见国家卫健委发布的2018乳腺癌诊疗规范): (1)首选含蒽环类药物联合或序贯化疗方案,常用的有:1)以蒽环类为主的方案,如CA(E)F、A (E)C、FEC方案(C:环磷酰胺,A:多柔比星,E:表柔比星,F:氟尿嘧啶)。2)蒽环类与紫杉类联合方案,例如TAC(T:多西他赛)。3)蒽环类与紫杉类序贯方案,例如AC→T/P(P:紫杉醇)或FEC→T。 (2)不含蒽环类的联合化疗方案,适用于老年、低复发风险、存在蒽环类禁忌或不能耐受的患者,常用TC方案。 (3)一般根据术后复发风险,选择不同的辅助化疗方案。高危患者,倾向于选择含蒽环和紫杉的方案,例如:AC-T、FEC-T、TAC、密集化疗AC-P等;中危患者,倾向于单含蒽环或单含紫杉的方案,例如:CAF、CEF、TC(6周期)等;需要化疗的低危患者,可选择4-6周期的单含蒽环或非蒽环方案,例如AC、EC、TC等。 (4)三阴性乳腺癌,除部分肿瘤负荷较小的患者外(如T1,N0),一般推荐A(E)C-T(P)的化疗方案,剂量密集型A(E)C-T(P)方案可优选用于部分可耐受的三阴性乳腺癌患者。这些推荐也是从NCCN指南引进。 图7.NCCN指南关于乳腺癌化疗推荐 总体上,以蒽环类加紫杉醇是TNBC化疗的基础方案,再根据患者的风险程度进行加减。这一方案中如果能用上白蛋白紫杉醇(Abraxane),毒性相对较低,但这药国内可及性还是比较低。 免疫检测点抑制剂(Tecentriq)目前已经被FDA批准用于TNBC联合治疗,主要基于IMpassion130研究结果,也是TNBC免疫治疗方面的突破。与单独单独使用Abraxane相比, Abraxane联合 Tecentriq使用可使未接受系统治疗的PD-L1阳性晚期或转移性三阴乳腺癌患者的疾病恶化或死亡的风险降低40%,PFS分别为7.4和4.8个月。 图8. IMpassion130研究结果 与免疫检测点抑制剂相比,PARP抑制剂用于带有BRCA1突变缺失的晚期乳腺癌患者相对较早。单药或联合化疗(吉西他滨和卡铂)都显示明显改善PFS和OS。但2014年发表在JCO的一个III期临床试验结果显示类似的联合用药未让患者获益(J Clin Oncol. 2014 Dec 1;32(34):3840-7.)。提示PARP抑制剂应用亦需要有严格的生物标志物指导,不能随便使用。 图9. PARP抑制剂联合化疗治疗TNBC数据(N Engl J Med. 2011;364(3):205-14.) 可以说,PARP抑制剂和免疫治疗在TNBC中取得的进展给TNBC患者带来了新的希望。当然这两种疗法需要严格的肿瘤分子标志物指导,包括BRCA1/2突变检测,肿瘤组织中PD-L1表达水平、肿瘤基因组微卫星稳定性(MSS/MSI)和突变负荷(TMB)的评估。而在临床实践中,为了降低医疗风险,几乎所有医院的肿瘤科大夫也都遵循NCCN指南与国内共识指南对患者首选化疗方案。然而,TNBC基因组变异复杂且分散,加上复杂的拷贝数变异。因此,面对如此强大异质性的肿瘤,指望一个AC化疗方案就能控制TNBC生长与演进几乎是不可能的。 图10. TNBC基因组变异谱(TCGA)(Nature 2012; 490: 61-70;Nature 2012; 486: 395-399;www.cbioportal.org/ ) 图11. TNBC各亚型基因组突变谱(Ann Oncol. 2018;29(4):895-902) 图12. TNBC各亚型基因组变异谱(拷贝数改变)(Ann Oncol. 2018;29(4):895-902) 从以上基因变异图谱看,尽管大部分TNBC都伴有TP53突变(>80%),但这个突变是没有任何靶向药物的。更为棘手的是,TNBC的驱动突变极为分散,没有任何一位患者是相似的。一些基因变异将会启动大致以下几条信号通路活化,为靶向药物使用提供可能。 图13. TNBC中常见活化并具有靶向潜力的信号通路( Am J Pathol. 2013;183(4):1064-74;Nat Rev Clin Oncol. 2016;13(11):674-690) 此外,BRCA1基因突变(胚系或体细胞突变)也大多发生在一些特殊形态学改变的低级别TNBC中,包括微腺性腺病(MGA)、不典型性微腺性腺病(AMGA)、腺泡性癌(ACC)。因此也不是所有的TNBC患者都适合用PARP抑制剂如奥拉帕利。 更重要的是,部分TNBC患者肿瘤组织中有广泛的淋巴细胞浸润,这种现象通常被认为是预后好的重要标志。然而,已有研究显示,这些浸润性淋巴细胞其实在TNBC中大多处于无能状态(Exhausion)(图15),加上免疫治疗(K药O药等)的副作用尤其是心脏毒性不可忽视(Lancet. 2018 ;391(10124):933.),提示免疫治疗手段不能盲试! 综上所述, AC方案化疗只是治疗TNBC的基础方案,这也是符合指南推荐。但对于高级别或晚期TNBC,AC方案不是终极武器,如果不做测序检测,明确驱动基因,精准治疗根本不可能实现!此外,不知道患者肿瘤的基因背景,化疗效果也可想而知。因为各种诊疗指南或共识只是大原则,是在没有明确驱动基因时的行动指南,而个体之间又是千差万别,一个治疗方案不可能适合所有患者;一旦驱动基因明确,就需要根据驱动基因选择治疗方案了。当然一谈到TNBC基因检测,大家可能认为只检BRCA1/2就解决问题了,那只是入门的想法。从以上TNBC复杂的基因组数据看,至少需要NGS大panels 或全外显子组测序(WES)才能初步解决患者的驱动基因筛选问题。因此,在精准医学时代里,撇开癌症基因组大数据和NGS检测报告精确解读去谈肿瘤精准诊疗,那是石器时代里痴人说梦。 因此,个人建议高级别或晚期TNBC患者要好好寻求专业咨询,做好样本病理质控,选择好基因检测方案;同时医生拿到检测公司的NGS报告后,需要做深入的临床再解读,才能好好优化治疗方案,不要只看检测报告里的小结页就匆忙决定治疗方案。当然低级别的TNBC患者就不需要那么焦急了,但愿患友们少走些弯路。简谈TNBC精准诊疗-写给我诊断过的TNBC患友们
一、 初识TNBC



二、 TNBC亚型



三、 TNBC精准治疗







 图14. 乳腺癌演进过程中免疫细胞功能耗竭(Cancer Discov. 2017 ;7(10):1098-1115.)
图14. 乳腺癌演进过程中免疫细胞功能耗竭(Cancer Discov. 2017 ;7(10):1098-1115.)