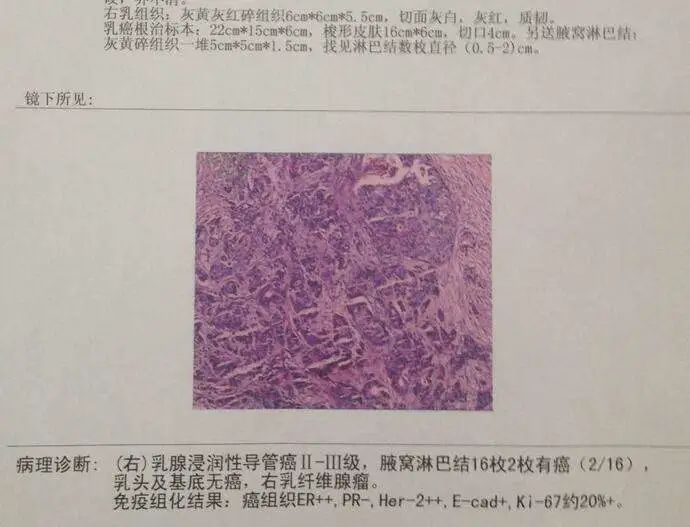
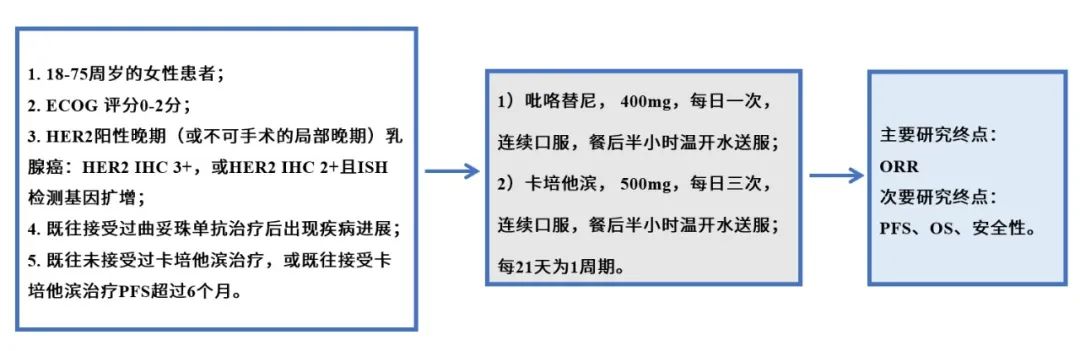
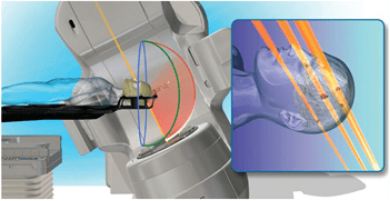
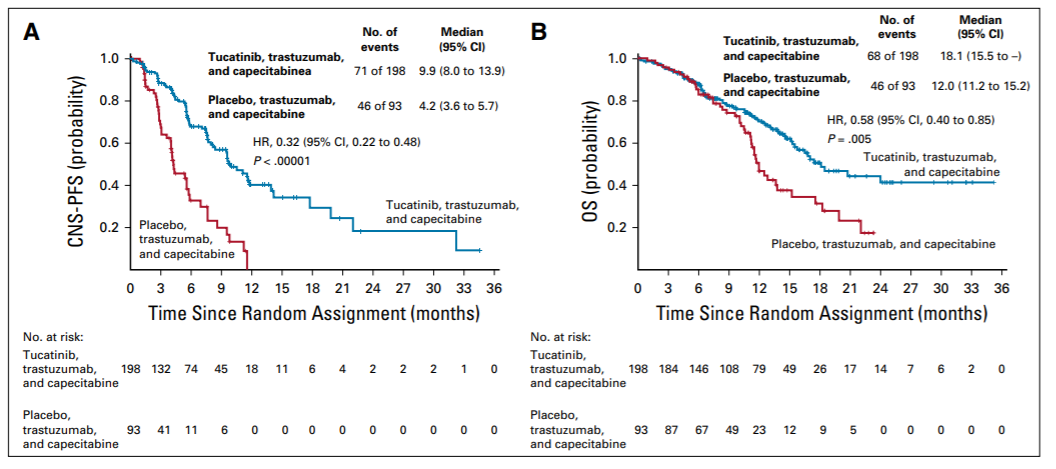
1.1 冠状动脉疾病 临床研究表明,冠状动脉疾病(CAD)在乳腺癌患者中的发生率高达85%。放疗导致CAD的机制较为复杂,可能与反复发生的内皮功能障碍、血管张力改变、凝血平衡异常和炎性系统激活等多个环节相关。各因素共同作用,使得内皮细胞的完整性受到破坏,单核—巨噬细胞得以进入内膜层,并诱导低密度脂蛋白沉积,继而形成脂肪条纹。这一过程和冠状动脉粥样硬化的形成机制颇为相似。 1.2 心肌损伤和心力衰竭 大多数放射性心肌损伤没有或尚未出现症状,因此临床上只有约10%的诊断率,通常表现为超声心动图上局部室壁运动异常,左心室肥厚,甚至充血性心功能不全。多数研究认为,心肌损伤的形成主要有两个因素。一方面是自身DNA及细胞结构受到放射线的破坏,即心肌细胞原发的放射性损伤,从而形成心肌纤维化。在小鼠模型上,这一过程从放射后6小时后即开始,至70天左右心脏出现非特异性广泛间质纤维化。另一方面是放射所致冠状动脉的狭窄闭塞,导致心肌供血不足而产生的继发心肌损伤。为了维持心输出量的稳定,心肌细胞的代偿活动不断加重自身损伤,直至这种高负荷运作难以为继,则会导致心功能下降甚至心衰。然而关于乳腺癌放疗是否最终引发心衰目前存在争议。既往认为放疗可以增加心衰风险的研究中多纳入或者掺杂了射血分数保留的心力衰竭患者,这些患者虽已形成器质性或功能性的心脏异常,但射血分数尚在正常范围内。至于射血分数下降的心衰,近期发表的一项102例1∶3病例对照研究则认为:在不联用蒽环类药物的情况下,中位平均心脏剂量(MHD)为6.8Gy时,放射治疗与乳腺癌射血分数下降的心衰风险增加无关。韩国国家健康信息数据库中91227例乳腺癌患者的病例对照研究也提示,年轻乳腺癌患者晚期充血性心力衰竭的发生率高于老年非乳腺癌患者,危险因素包括蒽环类和紫杉类药物,但不包含放疗。老年乳腺癌患者的充血性心衰发生率则与同龄人无异。 1.3 心包炎 2011年欧洲一项大型随访30年的回顾研究显示,乳腺癌放射性心包炎的发生率为6%-10%。临床上最常发生的心包炎为急性渗出性心包炎,尽管可能合并血液动力学异常,然而其中绝大多数为自限性的,只有约20%放射性心包炎会发展为有症状的缩窄性心包炎。多数研究认为,心包炎发生继发于毛细血管内皮细胞损伤以及淋巴管的狭窄或闭塞,由于毛细血管不含中间层和外膜层,管壁较薄,因此相较于冠状动脉更容易损伤。 1.4 瓣膜损伤 放疗引起的瓣膜损伤是一个更加缓慢的过程,瓣膜回缩及反流出现于放疗后10年左右,而瓣膜增厚纤维化、钙化和狭窄的形成则通常需要至少20年。有研究认为放疗可以上调转化生长因子、激活成纤维细胞和肌成纤维细胞,从而促进胶原形成和沉积。此外,放疗还能通过调节成骨诱导因子、碱性磷酸酶等生物因子引起瓣膜钙化。在相关文献报道中,主动脉瓣是最常见的受累部位,瓣膜的钙化也绝大多数发生于左心,因此可以推测,高循环压力也可能与瓣膜损伤相关。 1.5 传导系统异常 放射引起的传导系统异常并不常见,70%心电图异常半年后即可恢复正常,且放疗不会增加乳腺癌患者发生严重的心律失常风险。 总的来说,放疗引起心脏毒性的途径与DNA损伤、氧化应激、炎症反应、凝血激活、内皮细胞功能紊乱和心肌细胞纤维化有关。放射线通过多种途径导致内皮组织的损伤,引发毛细血管的减少和冠状动脉的狭窄,甚至闭塞,继而导致缺血性心脏病、心包炎等多种心脏疾病。同时心肌细胞的纤维化也参与了心肌病的发生。 心脏受照剂量是影响心脏毒性的重要因素,根据Darby等收集的1958年至2001年间接受放疗的2168例乳腺癌患者的病例对照研究,每增加1Gy的MHD主要的心血管事件风险增加7.4%。不同的靶区部位和范围往往心脏受照剂量不同,从而影响心脏毒性。一项系统综述中,左乳癌放射野包含和不包含内乳淋巴结区的计划中,MHD分别为9.2Gy和5.4Gy,而右乳癌的MHD则降至3.3Gy。 除放疗外,蒽环类化疗药物以及靶向药物曲妥珠单抗也具有心脏毒性,可能与放疗产生协同作用,影响RIHD的发生。台湾一项回顾性研究中,蒽环药物组、辅助放疗组发生主要心血管事件的风险比分别为1.47(95%CI:1.24-1.73)和1.48(95%CI:1.25-1.75),而蒽环药物与放疗联合时风险比提升至1.92(95%CI:1.65-2.23),相较于单纯放疗、单纯蒽环药物治疗组,联合治疗组患者心脏毒性发生风险增加。 即使受照部位、心脏剂量、全身情况等因素基本一致的患者,临床上仍然可能出现较大差异的放疗毒性,遗传因素是RIHD的重要影响因素。一些遗传综合征如共济失调性毛细血管扩张症(AT)的患者更容易出现放射性损伤。AT相关基因ATM上单核苷酸多态性(SNP)rs1801516的小等位基因、TGFB1基因的SNP rs1800469与乳腺癌患者放疗后的早晚期毒性相关。随着放射基因组学进展到全基因组关联分析研究领域,更多SNP如rs16958536、rs2840044和rs12243039与乳腺癌放疗损伤的相关性被挖掘出来。研究显示,SNP与毒性的这种关联似乎是具有肿瘤部位特异性。然而,基因和某种具体的毒性终点(如RIHD)的关系仍需要更多大样本研究证实。 既往心脏病史以及许多心脏疾病危险因素同样也是RIHD的危险因素,如年龄、吸烟、高血压、糖尿病、高血脂等。近期一项回顾研究也发现,对内乳淋巴结区进行照射的乳腺癌患者中,有心血管疾病危险因素的患者和无相应风险患者的缺血性心脏病的累积发病率分别为11.3%和6.4%。除此之外,生活作息也可能与RIHD的发生相关,在给予心脏18Gy的照射后,相比于规律昼夜组,昼夜生物钟紊乱组小鼠心脏收缩功能障碍及纤维化的发生率增加。 放疗计划中对心脏剂量的管理是目前预防RI-HD的手段之一。一些观点认为,心脏的剂量限值推荐在V25<10%,即照射剂量达到25Gy的心脏体积要小于总心脏体积的10%。然而Beaton等的研究中,即便所有左乳腺癌患者V25均未超过10%,10年心血管疾病的发生率仍有1.7%。因此单纯考虑V25<10%的限量并不能强有效地保护心脏,Beaton等认为应该将平均心脏剂量MHD作为考虑心脏限量的标准,MHD<3.3Gy可能是较为安全的;也有学者认为MHD在1.6-2.5Gy范围内可能是安全的,但心脏的安全剂量始终存在争议。即便是0-4Gy的小剂量,也可能引起相应心脏毒性的风险增加,临床工作中不能过分依赖现有心脏安全剂量标准,原则上心脏的剂量越低越好。 在此基础上,有研究提出对心脏的亚结构进行保护,但物理计划往往很难将亚结构和全心受量割裂开来考虑,不仅亚结构的剂量和整体剂量紧密关联,亚结构内的不同节段间剂量也密不可分,因此难以确定剂量-反应关系,效果也难以保证。例如,作为一条重要的也是放疗最易损伤的冠状动脉分支,左前降支的平均剂量预测主要冠状动脉事件的发生率的能力并不如MHD。 放疗技术的改进一方面提高了计划的适形性和均匀性,一方面减少了实际操作中因呼吸运动等原因产生的非理想剂量照射,为进一步降低心脏剂量带来希望,如容积旋转调强治疗、质子治疗、深吸气屏气技术和俯卧位放疗等。目前一项对比局部晚期乳腺癌质子和光子治疗疗效和心脏毒性的随机对照试验(NCT 02603341:RadComp)正在进行。近年来有关加速部分乳腺照射(APBI)治疗早期乳腺癌的研究十分热门。相较于全乳放疗,APBI可以降低心脏受量。令人遗憾的是,最近发表在Lancet杂志上的两项大型Ⅲ期临床研究结果显示,与全乳放疗相比,APBI并不能达到非劣效性检验。 药物预防也是研究热点之一。最近有一项对台湾癌症中心6993例早期乳腺癌的回顾性研究发现,在放疗期间应用二甲双胍可以降低RIHD发生率(HR=0.789;95%CI:0.645-0.965)。传统心血管疾病药物,如他汀类、血管紧张素转化酶抑制剂以及一些抗氧化剂也在小鼠模型上展现出一定预防能力。除此之外,适度运动也可以降低乳腺癌患者放疗后10年急性冠脉事件发生的概率。 乳腺癌患者放疗后产生心脏毒性的临床过程比较缓慢,当其发展成有症状的心脏疾病时,往往已较为严重甚至危及生命。因此,在目前早期乳腺癌可以长期生存的时代,如何及早以及有效地监测隐匿性心脏毒性的发生,并及时干预十分重要。 生物标志物作为心脏疾病常用的监测手段,受到研究者的广泛关注。其中,肌钙蛋白已作为监测化疗毒性的指标,但其在放疗领域中的应用较为局限。放疗前后肌钙蛋白T(TnT)或肌钙蛋白I(TnI)并没有明显改变,且近期研究认为,即使是高灵敏TnT(hsTnT)于放疗6个月内也没有明显变化,并与MHD无关。另一研究中发现乳腺癌亚组放疗前后hsTnT、胎盘生长因子(PIGF)和生长分化因子15(GDF-15)等心血管相关生物标志物也与MHD无关。然而该研究中淋巴瘤和肺癌亚组可以观察到放疗后PIGF和GDF-15显著性上升,并与MHD、V5和V30均呈现相关性。以上研究提示:(1)心肌细胞损伤则难以通过目前常见的标志物(如hsTnT)水平进行监测;内皮细胞损伤修复相关的生物标志物(如PIGF,GDF-15)或更有意义;(2)相较于心脏受量较高的淋巴瘤和肺癌,乳腺癌所产生的早期心脏损伤更难进行监测,未来仍需对更灵敏的生物标志物进行探究。 超声心动图作为评价心包疾病、左室功能和瓣膜结构的首选影像学检查在心脏疾病评估中起着十分重要的作用。然而,放疗结束后初期,超声心动图往往不能反映早期损伤,出现异常大多提示已经发生晚期、严重的心脏毒性。组织多普勒成像是应用多普勒效应检测心室肌运动的一种方法,与传统多普勒超声相比结果更可靠;而应变率成像则是在组织多普勒基础上发展的评价心肌运动的技术,被认为可以成功显示放疗后早期亚临床心脏损伤。 由于许多心脏毒性的第一步是冠状动脉的损伤,近年来有研究希望利用核素显像技术监测放疗后早期心肌的灌注水平以反映冠脉功能。Kaider-Person等综述显示,利用单光子发射计算机断层扫描(SPECT)对乳腺癌放疗后心肌灌注水平进行监测的研究中,3项研究认为心肌灌注水平不足的百分比和剂量呈正相关,2例对心脏进行保护(如深吸气技术等)的研究则显示心肌灌注不足与放疗无明显相关性。也有小样本研究利用正电子发射断层扫描(PET)对灌注进行监测,未发现明显差异。考虑到SPECT和PET费用高昂,操作复杂,利用这两种技术进行早期心脏灌注监测的意义仍需要商榷。此外,心电图简单、方便、无创,临床上常用于常规检查和心脏疾病的初筛,但是由于受到多种因素的影响,对早期RIHD的诊断意义也不大。 放疗引起心脏毒性的治疗 目前尚无对RIHD十分有效的治疗,多与其他非放疗引起的心脏疾病相类似,针对不同亚结构的损伤给予不同治疗,但治疗效果欠佳。例如前文提及ACEI对RIHD可能存在一定预防作用,但ACEI的代表药物卡托普利却并不能改善放疗后引起的心功能恶化。因此RIHD仍然重在预防。 尽管如此,药物的基础实验还是带给我们一些希望,我国传统医学也在这方面有所进展。 乳腺癌的诊治近年来取得的可喜进步,生存率得到了很大的延长,与此同时RIHD的危害渐渐凸显。RIHD诊断时多已出现较为严重的器质性或功能性异常,且目前尚无十分有效的针对性治疗,因此如何积极预防、及早发现是人们研究的热点。日新月异的放疗技术(如容积旋转放疗、质子治疗),日趋完善的防护技术(如深吸气屏气技术、挡板的设置)以及更加灵敏的检测手段(如生物标志物、应变率成像等),都给预防和控制RIHD带来希望。同时,研究者们也试图找到高危患者进行个体化的干预,如通过RIHD的影响因素建立模型,希望对乳腺癌患者未来遭受心脏损伤的风险进行预测,指导临床。 RIHD分类和机制
RIHD影响因素
RIHD预防

RIHD监测
结语