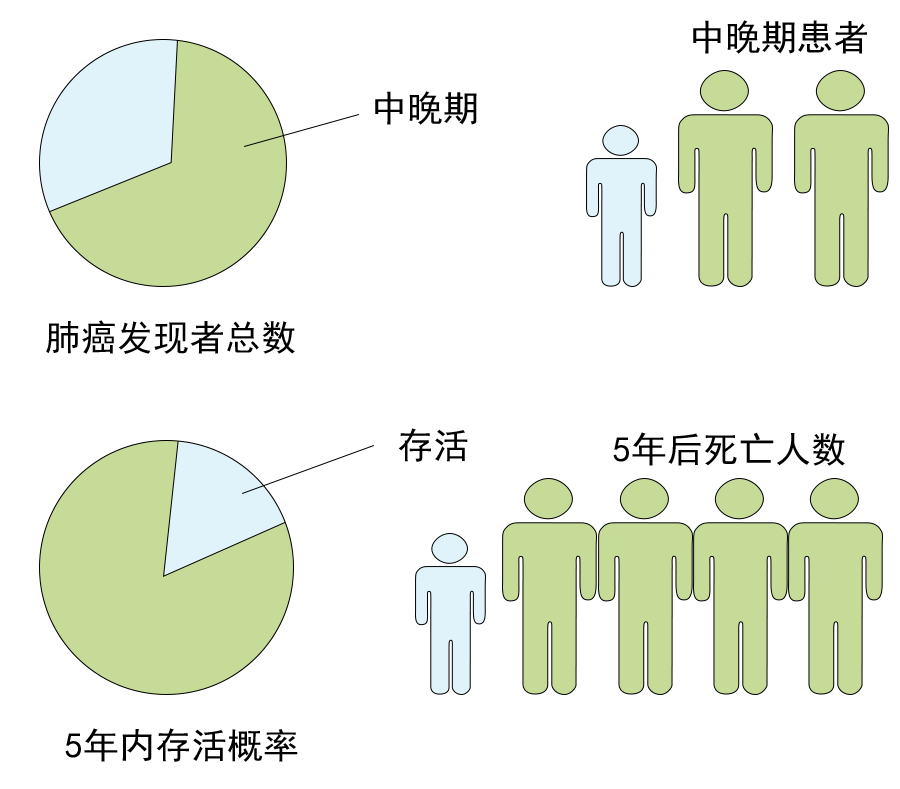
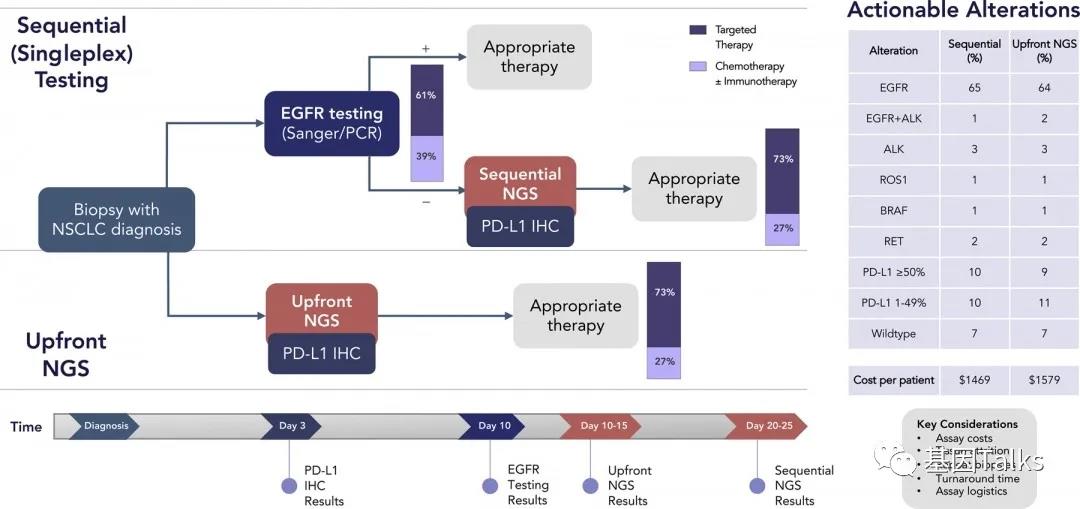
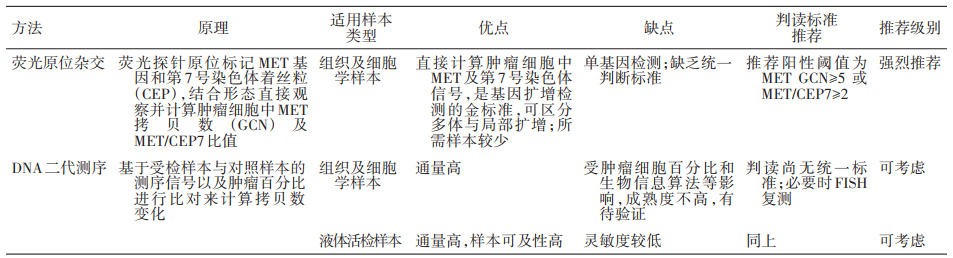
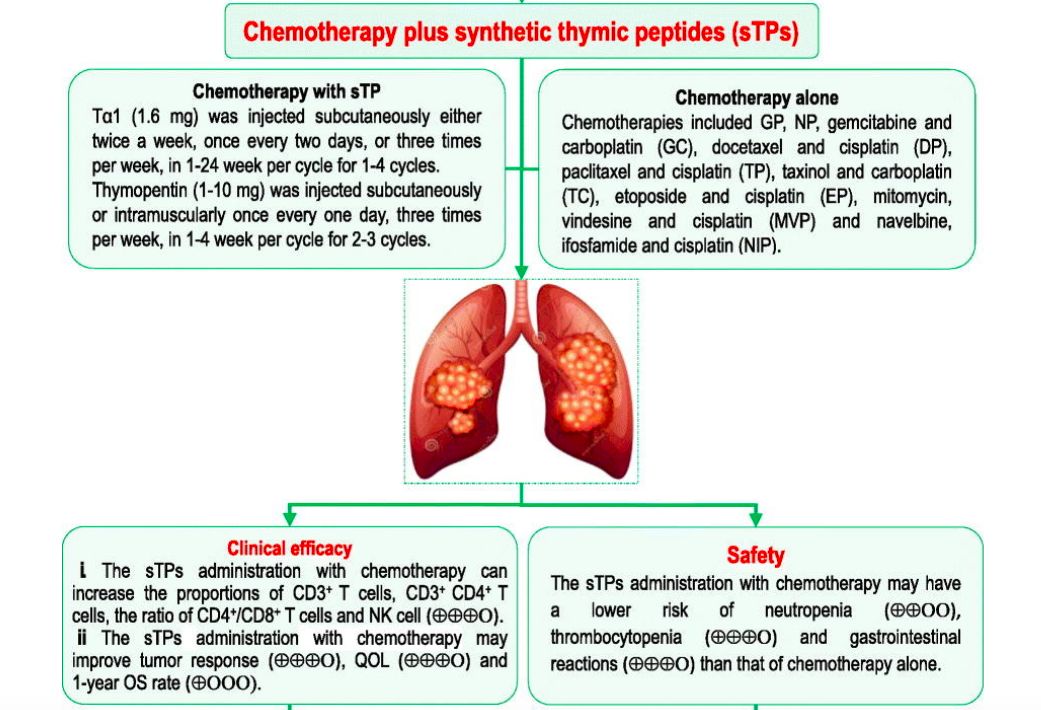
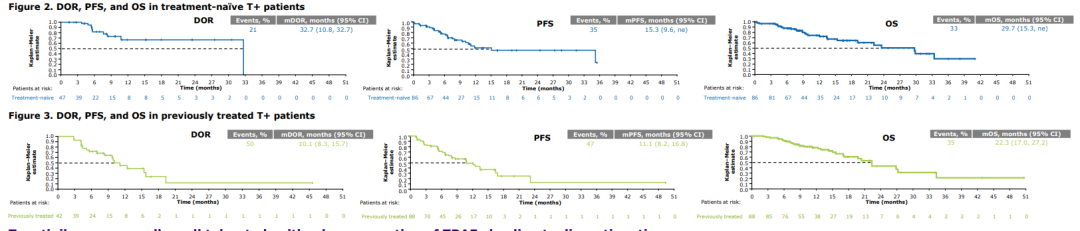
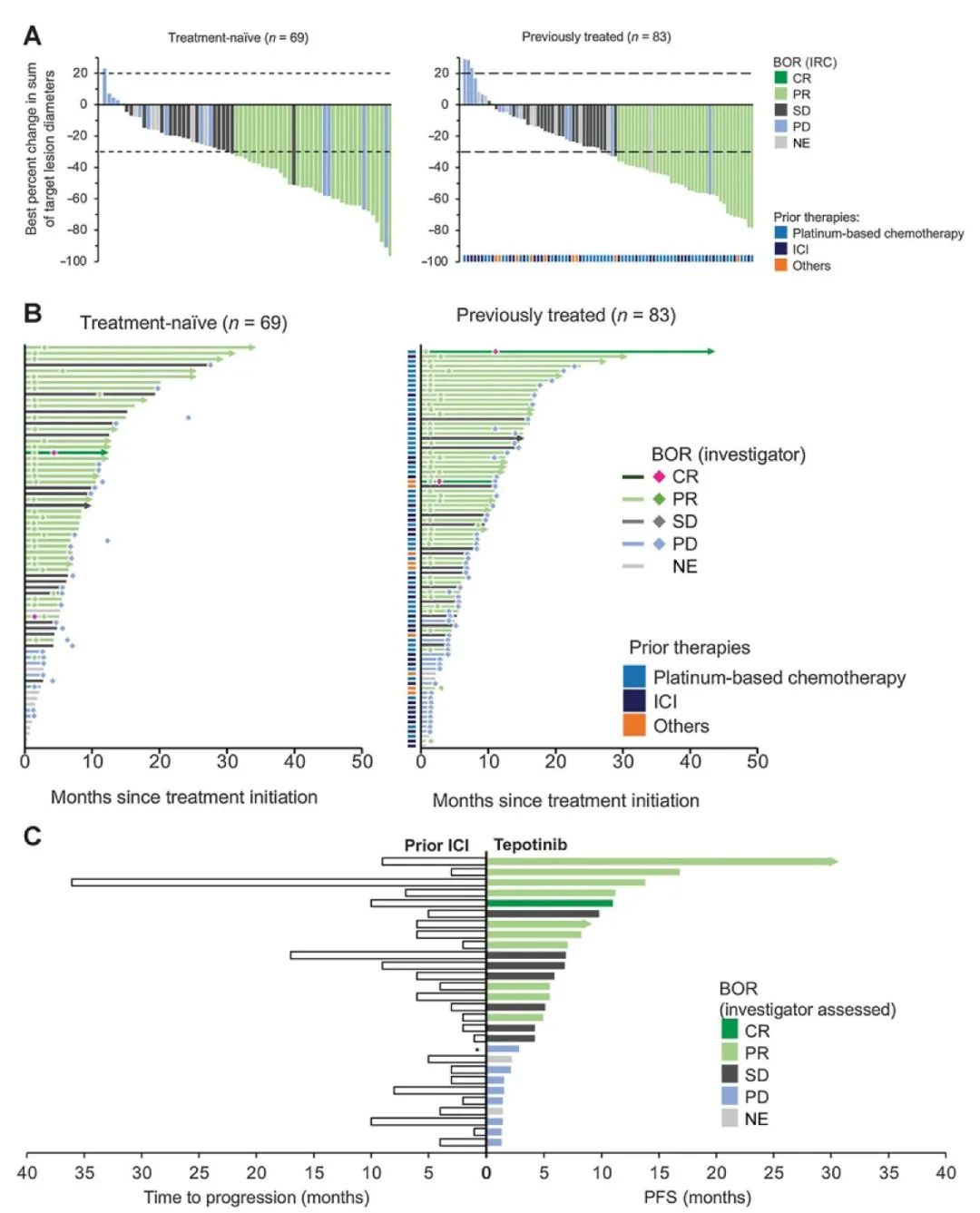
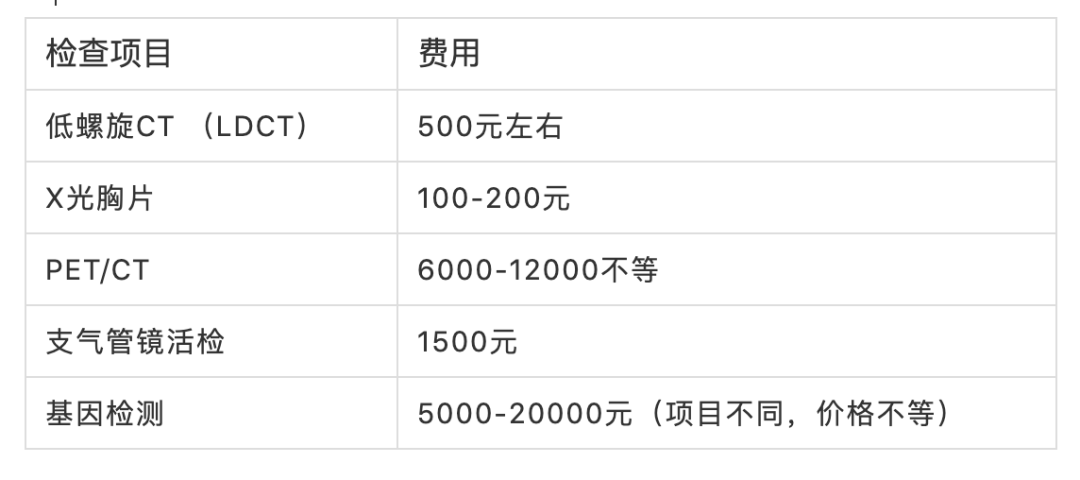
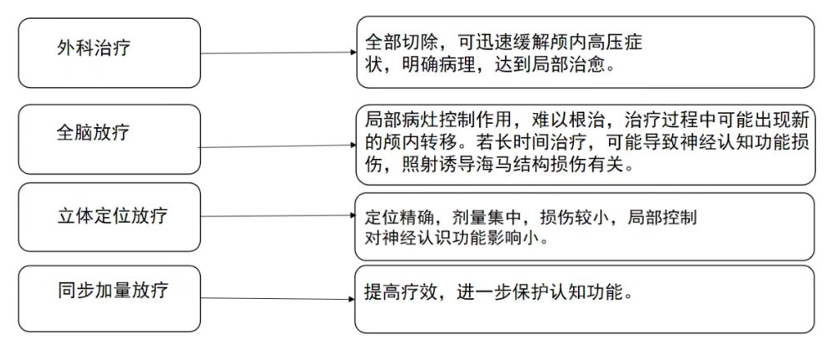
肿瘤突变负荷(TMB) 是目前免疫检查点抑制剂疗效预测三大标志物(PD-L1表达,TMB,微卫星不稳定)之一,被定义为肿瘤基因组区域中每兆碱基 (megabase, Mb)发生的碱基替换突变和插入缺失突变的 数量总和,单位为muts/Mb,可以间接反映肿瘤产生新抗原的能力。2020年,被FDA获批作为PD-1单抗——帕博利珠单抗的伴随诊断标志物,从而被临床广泛关注,“高肿瘤突变负荷TMB-H”也成为了继MSI之后,派姆单抗第二个“不限癌种”的适应症,即作为单药疗法,用于治疗先前治疗后病情进展、无令人满意的替代治疗选择、不可切除性或转移性高肿瘤突变负担(TMB-H≥10 muts/Mb])的实体瘤儿童和成人患者的适应症。 虽然WES是检测 TMB的金标准,但WES时间成本和分析成本较高。经 过多项大样本研究验证后,TMB检测从WES扩展到了更切合临床实际的靶向二代测序(next generation sequencing panel, NGS panel)
共识一:WES是TMB检测的金标准,但目前测序成本和分析难度较高。NGS panel与WES 的TMB检测结果具有高度一致性, 经过验证的NGS panel可作为临床检测TMB的替代方式。
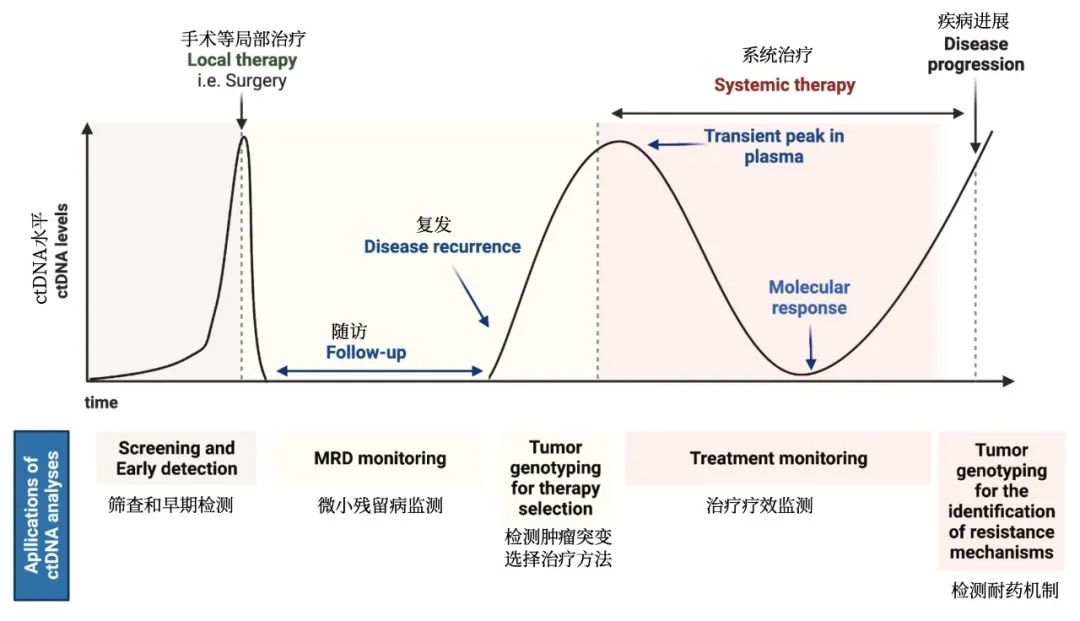
共识二:通过病理质控的石蜡包埋肿瘤组织方可用于TMB检测。在肿瘤组织获取困难或石蜡包埋样本中肿瘤细胞含量不足的情况下,晚期NSCLC患者可选择外周血进行基于ctDNA的bTMB检测。
共识三:既往未接受过免疫治疗的晚期NSCLC患者,在接受免疫单药治疗前推荐进行TMB检测。TMB预测SCLC一线免疫治疗疗效的临床证据尚不充分,暂不作为提示免疫一线治疗疗效标志物,但可考虑作为二线及后线免疫治疗的疗效标志物。
共识四:不推荐PD-1/PD-L1抗体联合化疗的晚期NSCLC或SCLC患者接受TMB检测。
共识五:暂不推荐TMB用于预测免疫新辅助治疗疗效。
共识六:目前尚没有公认的区分高、低TMB的cut-off值,推荐各免疫治疗药物根据各自临床研究数据确定cut-off值,并进行前瞻性验证。
共识七:TMB检测报告应呈现纳入TMB计算的基因变异类型、TMB排序以及支持TMB排序的参考数据库,并提供辅助临床决策所需要的医学证据。
共识八:建议联合PD-L1表达、免疫治疗相关基因、组织和循环中的免疫细胞等信息,对TMB指导肺癌免疫治疗进行综合解读。
《肿瘤突变负荷应用于肺癌免疫治疗的专家共识》由中国医学科学院肿瘤医院王洁教授、同济大学附属上海市肺科医院周彩存教授、上海交通大学附属胸科医院韩宝惠教授发起,四川大学华西医院周清华教授、东部战区总医院宋勇教授等共同担任编撰指导专家,由60多位来自全国各地的肺癌专家担任讨论专家,共同完成。