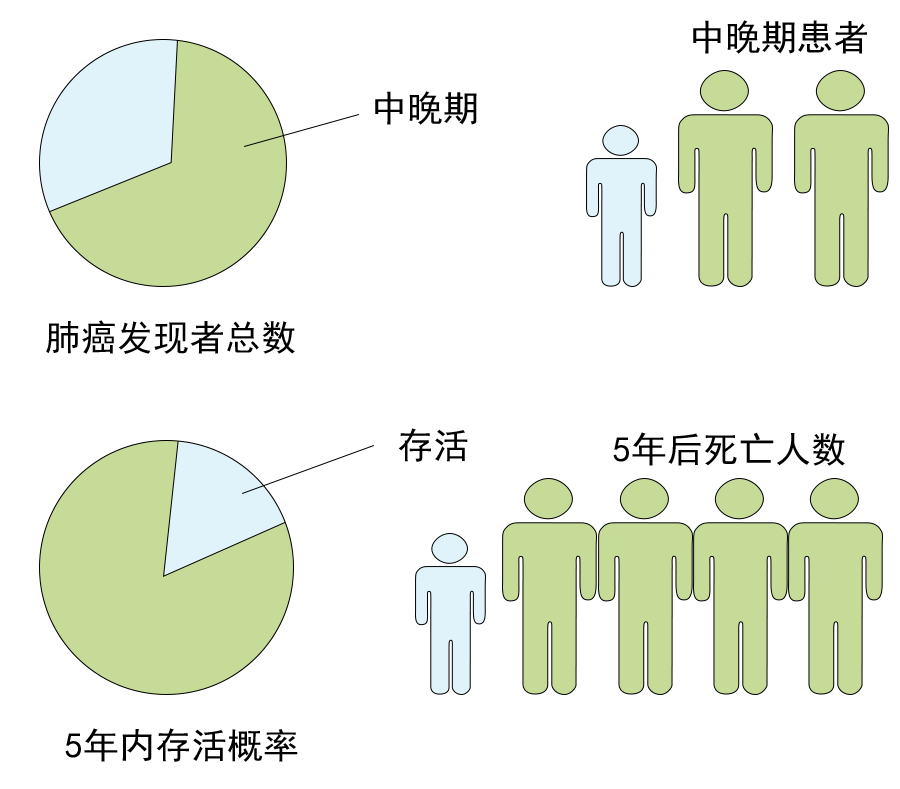
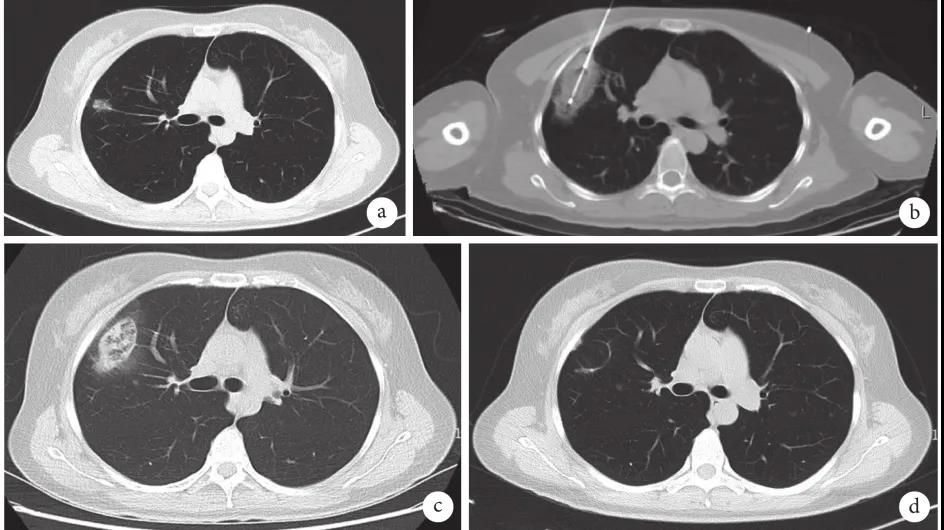
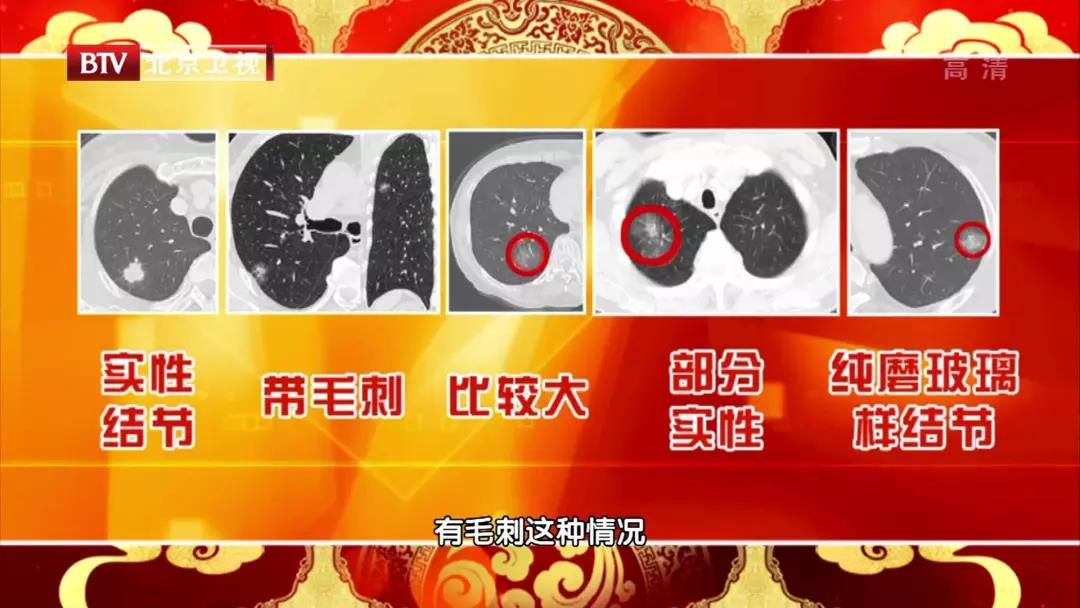
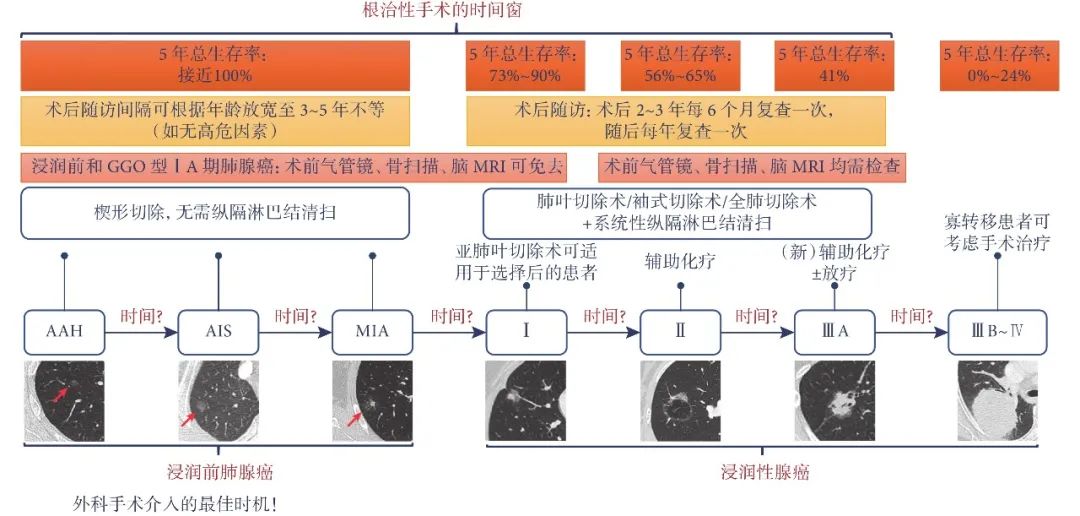
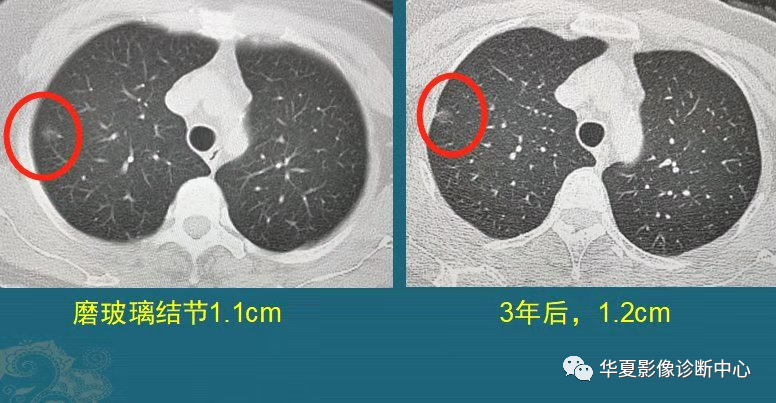
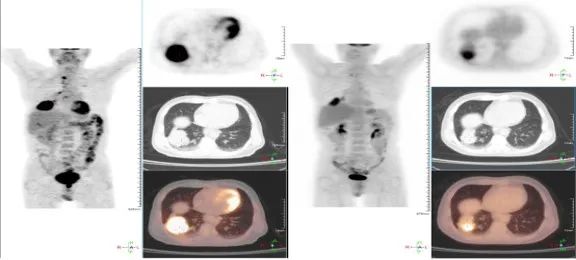
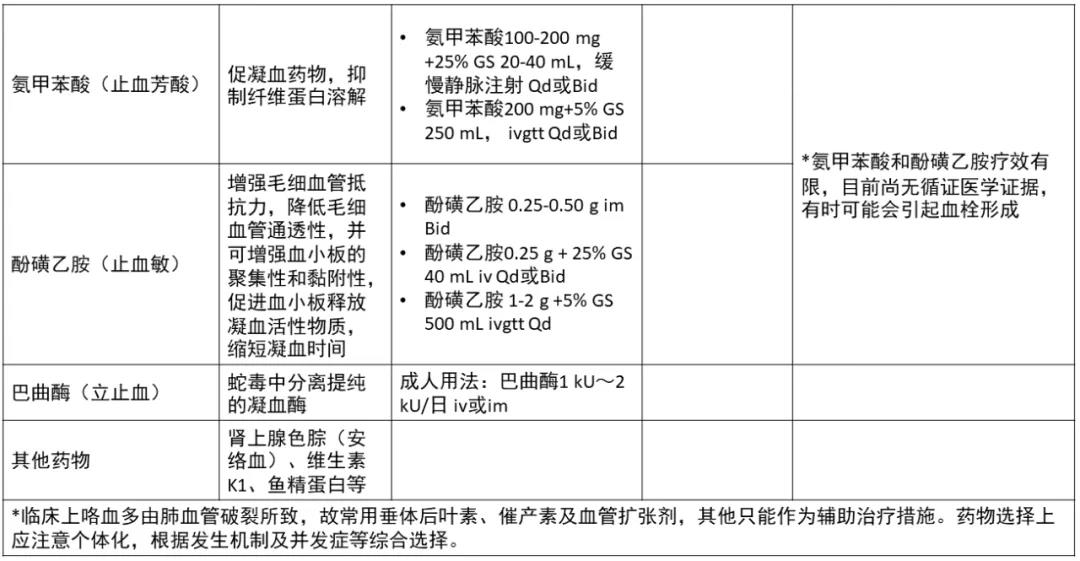
肺磨玻璃结节(ground-glass nodule,GGN)是体检或偶发早期肺癌的主要表现形式,常见于年轻、女性和不吸烟人群,正确的随访与处理策略可在降低肺癌死亡率的同时避免过度治疗。持续存在的GGN大多数为腺癌或前驱腺体病变,但呈惰性生长或长期不生长,有条件的随访是十分安全的。GGN必须采取个体化诊治策略,在充分考虑浸润程度、动态变化、治疗疗效与并发症、患者身体状况及心态等因素后做出治疗决策。不同于其它类型肺癌的尽早治疗策略,GGN型肺癌治疗时间窗很宽,必须在充分考虑治疗利弊后确定治疗时机。 外科手术是主要根治手段,对表现为GGN的前驱腺体病变目前普遍采取亚肺叶切除及不清扫淋巴结的术式。鉴于绝大多数GGN型肺癌属于无转移的局部病变,对不宜或不愿外科手术者可考虑采用介入根治。一般采用经皮微波、射频及氩氦刀等消融技术进行介入根治,具有创伤小、对肺组织损伤轻、可多次操作及可同步活检等优点,现有的研究结果已证实了消融治疗的可行性。超声与导航引导下经支气管消融治疗肺结节的疗效已初步得到了证实,是介入根治GGN的新途径。 未来在GGN的治疗上,消融治疗有望与外科手术同等重要,根据病灶特点、部位及患者情况等来选择治疗方法,以求患者利益最大化。近几年来,消融治疗 GGN 的探索逐渐增多。本文将在进一步认识 GGN 的基础上,探索 GGN 的诊治策略,并从呼吸介入角度,介绍消融治疗在 GGN 中的应用。 关键词:磨玻璃结节;诊治策略;经皮消融;根治 【正 文】 肺部磨玻璃结节(ground-glass nodule,GGN)指高分辨率CT表现为肺内边界清楚或不清楚的直径(或最大径) ≤30 mm的圆形或类圆形密度增高阴影,但病变密度不足以掩盖其中走行的血管、支气管、小叶间隔等结构,可为单发或多发,不伴有肺不张、肺门及纵隔淋巴结肿大和胸腔积液。 随着影像技术的发展、肺癌筛查的普及,GGN的检出率明显上升,因其与肺腺癌密切相关而备受关注。近年来多个国家、地区开展了肺癌筛查研究并提示,肺癌高风险人群中GGN的发病率为2.0%~3.3%。国内有报道在普通人群筛查发现的肺癌中,84.8%~95.5% 的患者在影像学上表现为GGN。与传统观念中的肺癌好发人群不同,大量研究数据显示恶性GGN好发于年轻、非吸烟、女性。 目前GGN在筛查、随访、治疗策略等方面缺乏共识,手术仍是拟诊GGN型肺癌根本的治疗策略,尽管最佳术式还存在争议。随着介入消融技术的发展,其应用范围也在不断拓宽。近几年来,消融治疗GGN的探索逐渐增多。本文将从GGN认识上的进展、诊治策略及经皮消融技术根治GGN的现状与探索等方面展开。 GGN根据是否存在实性成分可分为:纯磨玻璃结节(pure GGN,pGGN)和混合磨玻璃结节(mixed GGN,mGGN),前者又被称为无实性结节,后者又被称为部分实性结节(图1)。GGN的病理基础是肺泡间隔增厚,或部分肺泡腔充满液体、细胞或组织碎片,因此GGN并非某病的特异表现,它既可见于浸润性肺腺癌、腺体前驱病变,又可见于局灶性间质纤维化、肺泡出血、炎症或细支气管上皮增生、细支气管周上皮化生等。持续存在的GGN是指结节至少持续存在3个月以上且复查时未变小或消失。应特别重视持续存在的GGN,因其多为恶性或有向恶性发展的潜能。Kim等报道有超过80%持续存在的GGN最终被诊断为腺癌或前驱腺体病变。Lim等的研究也发现,最大径≥10 mm持续存在的pGGN手术病理100%为腺癌或前驱腺体病变。 GGN型肺癌均为腺癌,多数学者认为是经有序的多阶段发展而来的。从影像上由pGGN发展为mGGN或实性结节。在病理学上,通常是由非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)到原位腺癌(adenocarcinoma in situ,AIS),再进一步发展为微浸润腺癌(minimally invasive adenocarcinoma,MIA)、浸润性腺癌(invasive adenocarcinoma,IAC)。 GGN是一种非特异性的影像学表现,但其影像特点对于判断病理性质帮助很大,多数GGN的影像与病理存在相关性。纯磨玻璃影被认为是AAH或AIS的表现,当pGGN<5 mm时多为AAH;介于5~30 mm,AIS的可能性最大。 但值得注意的是,即便是pGGN,少数可能是MIA,极少数甚至已是IAC,其中大部分为贴壁生长型,但也有少数呈非贴壁生长型。而对于mGGN,当实性成分直径<5 mm以MIA多见,≥5 mm则提示IAC的可能性较大。GGN病灶越大,实性成分越多,其恶性可能性越大,侵袭性越强。此外,结节的形态,边缘(毛刺征、分叶征、血管集束征)及内部结构特征(CT值、空泡征、支气管充气征等)也是鉴别良恶性、侵袭性的重要影像征象。 现有的研究数据表明40%~50%的GGN在随访3~4个月时消失,这些属于暂时性GGN,考虑为良性病变。持续存在的GGN虽然多为腺癌或前驱腺体病变,但长期随访多无变化,仅少数出现生长。Chang 等报道122个pGGN随访近5年,90.2%未见生长。日本国立癌症研究中心牵头的一项多中心前瞻性研究发现,在4.3年的平均随访期内,1 046例pGGN中仅6.6%发展为mGGN。与pGGN相比,mGGN在随访中出现生长的比率较高。Sawada等的研究发现24.2%的mGGN在5年随访期内生长,远高于pGGN的12.8%;而且实性成分占比(consolidation/tumour ratio,CTR) 越高,生长的可能性越大,CTR 0.1~0.25、0.26~0.5、>0.5的mGGN随访5年的生长率分别为14.2%、28.6%、30.8%。GGN即使生长也呈惰性缓慢生长,倍增时间很长。根据研究报道mGGN的倍增时间是457~568 d,pGGN更是长达469~845 d。有研究数据表明,GGN的生长绝大多数发生在3~5年内。有一项研究报道CTR<0.5的108个GGN,平均随访4.2年,26.9%在随访期内增大,且均在随访3年内出现。Lee等报道了351个GGN随访10年的研究数据,发现后5年的GGN生长率不及前5年的1/3。对GGN生长规律的了解,有助于我们做出正确的处理策略,避免过度诊治。 如前所述,持续存在的GGN多数为腺癌或前驱腺体病变,根据影像特点是无法排除恶性病变的。因此,高分辨率CT发现GGN后如果3个月随访无缩小或消失就需要进行长期随访,直至可排除恶性。GGN生长缓慢或长期无改变,故随访期限一般至少5年。随访时间间隔应根据恶性风险及可能的浸润程度、患者的具体情况而定。 目前在国内外有许多相关的指南、共识,但由于各指南、共识制定者的专业背景、地域以及针对人群的不同,推荐的GGN随访策略差异较大。其中几个主要指南、共识的随访策略归纳见表1。指南及共识的策略差异导致了临床医生的困扰,但在临床工作中这些指南、共识只能提供参考,在对GGN的具体处理上应针对不同患者、病灶制定个体化的随访策略。 表1 国内外主要指南、共识对磨玻璃结节随访及处理的建议总结 我们结合长期的临床经验,提出以下几点供参考: GGN初次发现后均应3个月随访,大多数良性GGN会有缩小或消失; 首次随访无变化者应根据影像特征评估恶性风险及可能的病理类型,可疑AAH者可年度或2年后随访,可疑AIS者可6~12个月后随访,可疑MIA者 3~6个月后随访,可疑IAC者 3个月后随访或考虑活检、治疗; 后续随访时间间隔根据前一次随访评估的病理类型确定,在动态随访中如出现结节增大、实性成分增加或新出现恶性征象应缩短随访间隔或进行活检、治疗,如病灶持续稳定,可适当延长随访间隔时间; 必须结合患者身体状况及心态等因素来确定GGN的随访策略。对于预计生存期有限的高龄、合并严重慢性疾病患者,随访不宜过于积极,甚至可长期不随访;对于心态十分焦虑的患者,随访应相对积极。 GGN密度较低且存在正常的肺内血管,与实性结节相比非手术活检确诊率相对较低、出血风险较大,同时对恶性的浸润程度判断也欠准确。然而,非手术活检仍是GGN除外科手术以外唯一的确诊手段,具有明确病变性质以便对因治疗、避免外科误切、缓解患者心理压力等作用。因此,严格筛选非手术活检的适应人群及充分掌握活检技术也是GGN诊治策略的重要一环。 GGN非手术活检的主要适应证包括:有典型恶性特征但不愿或不宜外科手术、疑诊为可经内科治愈但病因不明的良性疾病、同时存在类似的多发结节且不能排除恶性;且均必须通过评估确认非手术活检可取到合格标本。活检途径分为经皮及经支气管两种,前者宜用于无支气管相通、活检部位无明显血管的病灶,后者则主要用于与支气管管腔相通的结节病灶。经皮穿刺活检是肺结节诊断的传统有效技术,报道的GGN诊断率约64.6%~93%。对≤1 cm的GGN确诊率差别更大,48.5%~87%不等。近来,经引导鞘管超声支气管镜(endobronchial ultRASonography with a guide sheath,EBUS-GS)及导航技术的应用,大大提高了GGN经支气管活检的确诊率及安全性,其阳性率达到57%~69%,病灶越大阳性率越高,而且高分辨率CT可见支气管与病灶中间相通者确诊率更高。冷冻活检能够取到较大的标本,有望明显提高诊断率。有研究[49]报道EBUS-GS联合超细探头冷冻肺活检诊断率可达到82.61%,且诊断率与病灶大小、CTR、是否采用导航或X线透视等因素无关,值得进一步探索。 除非高度怀疑真菌感染或浸润性肺癌,一般需在随访3个月以上才考虑活检,以避免不必要的活检。 GGN病灶及其周围存在正常肺部血管,经皮穿刺活检进针及活检切割时必须尽量回避较大血管,防止大出血。 pGGN经皮穿刺活检阳性率较低且出血风险大,必须慎用。 如病灶部位血管丰富,于微波或射频热消融中或消融后进行经皮穿刺活检可减少出血量、提高安全性,且不影响活检的病理检查结果。 为提高诊断率及减少并发症,经支气管镜活检应该在超声探头可探及病灶的前提下进行,冷冻肺活检最好在X线实时透视下采用细探头取材。 外科手术切除是拟诊恶性GGN的主要治疗方法。《上海市肺科医院磨玻璃结节早期肺腺癌的诊疗共识(第一版)》中对可疑AIS、MIA及IAC的GGN的手术指征做了较为详细的说明,但病理类型仅通过影像特征分析得出,存在不准确的可能性。 目前相对比较一致的观点是当多学科会诊后高度怀疑IAC病变时,应手术干预。对于影像特征怀疑为AIS或MIA时,需要根据病变部位、随访时间长短、发展为浸润病变的概率等因素综合考虑。GGN型肺癌是一种惰性的肿瘤,有条件随访十分安全,治疗窗口期很长。因此,对前驱腺体病变不应过早积极手术干预,以避免过度治疗。另外,是否考虑手术治疗必须结合病灶部位、结节数量、患者的预计生存期及心态等,对于非优势部位、双侧多发、高龄或有严重基础疾病者手术宜消极,反之则可积极考虑手术治疗,当患者对GGN十分焦虑时手术指征也可适当放宽。 随着临床研究的深入,临床医生对GGN的切除范围有了更准确的认识。基于1995年的一项随机对照研究(RCT),肺叶切除被认为是早期肺癌的标准术式。然而对于肺结节病灶,尤其是近几年来备受关注的GGN型肺癌,最佳的切除范围还存在争议。切除范围的选择,需要综合考虑病灶影像特征及部位、患者年龄及心肺功能等因素。日本的Ⅱ期临床研究JCOG0804/WJOG4507显示,对最大径≤2 cm,CTR≤0.25的GGN型肺癌进行足够切缘的亚肺叶切除,5年无复发生存率达99.7%。美国国立综合癌症网络(NCCN)指南已推荐亚肺叶切除可用于最大径≤2 cm,CTR<0.5的外周GGN(2类)。而对于CTR>0.5的病灶,其术式的选择仍存在争议。参考NCCN指南的建议,对于CTR>0.5的mGGN,在患者可耐受的情况下仍优先考虑肺叶切除。但近年来国内外开展了一些研究,试图探索这部分患者的最佳术式,也提出了新的观点。国内有临床研究报道,CTR>0.5的mGGN行肺段切除与肺叶切除的5年无复发生存时间相仿。 另有两项针对直径≤2 cm mGGN的RCT正在进行(日本的JCOG0802和美国的CALGB140503),从JCOG0802已报告的部分研究结果来看,对于最大径≤2 cm、CTR>0.5的mGGN,肺段切除无论是总生存率还是肺功能保留方面都优于肺叶切除,但还需待其最终研究报道。尽管如此,目前支持亚肺叶切除用于CTR>0.5 的mGGN的证据尚不足,有待进一步研究。除了病灶大小、CTR外,术中冰冻病理可以辅助GGO病灶的术式选择。有一项纳入803例Ⅰ期肺腺癌患者的研究发现,术中冰冻病理判断AIS、MIA、IAC的准确率可到达96%。对于术中病理为AIS、MIA的GGN行亚肺叶切除,5年无复发生存率达100%。 为达到术中创伤最小化及术后生存期最大化的目的,外科学者也在不断探索GGN型肺癌术中淋巴结的处理方式。多项研究结果提示GGN的淋巴结转移率很低,pGGN的淋巴结转移率为0,CTR<0.5的mGGN其淋巴结转移率0~6.9%。Moon等的研究提示肿瘤大小和CTR是淋巴结转移的独立预测因素。一项纳入129例CTR<0.5的GGN患者的回顾性研究发现,无论是否进行淋巴清扫、采样,患者的5年无复发生存率无差异。还有类似的研究也提示,对于CTR<0.5的GGN,淋巴结清扫与否并未影响患者的预后。根据2021年NCCN指南的建议,对于最大径<2 cm,CTR<0.5的外周GGN,技术允许情况下需进行N1、N2淋巴结采样。而对直径>2 cm或CTR>0.5的GGN,目前更为推荐系统性淋巴结清扫。此外,术中冰冻病理也是淋巴结处理方式的重要参考指标。有研究结果提示,对于术中冰冻病理为AIS及MIA未进行淋巴结清扫,其5年无复发生存率可达100%。考虑到AIS及MIA不发生淋巴结转移,《上海市肺科医院磨玻璃结节早期肺腺癌的诊疗共识(第一版)》指出,对于影像拟诊AIS或术中冰冻初步诊断为MIA,不需要进行淋巴结清扫或采样。基于目前的研究结果,我们认为在进行术式选择时不能一概而论,要充分考虑GGN的大小、形态、位置、CTR等因素,参考术中冰冻病理结果,选择可根治、创伤小、尽量保留肺功能的术式。 除了外科手术,立体定向体部放疗(stereotactic body radiation therapy,SBRT)及消融技术介入治疗也是肺结节的治疗手段。SBRT可用于经多学科联合诊疗认为不能耐受外科手术的早期肺癌。然而,GGN病灶存在剂量传递及实时影像引导难以实行等问题,关于SBRT治疗GGN的研究甚少。有项单臂回顾性研究提示SBRT治疗GGN型肺癌可获得较好的局部控制。另外还有少数SBRT治疗早期肺癌的研究中包含少量GGN病灶,提示磨玻璃病灶与更好的预后相关。但目前缺乏足够的证据支持SBRT用于拟诊GGN型肺癌的治疗。 肺癌的经皮介入治疗技术主要包括热消融如射频消融(radiofrequency ablation,RFA)、微波消融(microwave ablation,MWA),冷冻消融如氩氦刀冷冻消融(argon-helium cryoablation,AHC)以及放射性粒子植入等,目前临床常用于早期肺癌的消融技术是经皮RFA、MWA 、AHC等。 RFA是目前治疗实体瘤最为广泛的消融技术,也是应用于肺部肿瘤最早,经验最丰富的消融治疗手段。消融体积主要取决于局部射频产生的热传导与血液及细胞外液间的热对流,但其热沉效应明显,易受组织特性影响。在肺部,RFA主要适用于小到中等大的肺癌。近年来,RFA用于治疗不能耐受或拒绝手术的Ⅰ期肺癌的报道越来越多,结果提示其无复发生存或总生存与手术或SBRT相当。研究还显示RFA治疗早期肺癌的5年无进展生存率为40%~74%,而肿瘤大小是其预后的重要影响因素,<3 cm的肿瘤预后更佳。2013年美国胸科医师学会(ACCP)推荐RFA用于<3 cm且不适合手术的外周型Ⅰ期非小细胞肺癌。 MWA是将微波消融针(微波天线)穿刺到靶组织内产生微波能量,使肿瘤细胞凝固坏死。MWA具有肺内对流性更高、热沉效应更弱的特点,其消融范围较RFA大,而且所需的消融时间更短,耐受性更好。理论上MWA相较于RFA可能获得更好的肿瘤局部控制。近10年来,MWA治疗早期肺癌的研究也逐渐增多。一项纳入104例Ⅰ期非小细胞肺癌的研究发现,MWA治疗后的局部复发率为23%(中位随访时间47个月),而肿瘤>3.5 cm是局部复发的独立危险因素。而且该研究还对复发者再次进行MWA,这些患者与未复发者的生存结局相仿。该研究给了我们两点启发:首先是严格控制消融治疗的肿瘤大小,可以获得更好的局部无复发生存;其次是复发者可重复MWA治疗,其预后与未复发者一样。Han等的研究发现MWA治疗75岁以上早期肺癌患者的4年肿瘤特异性生存率为64.7%。一项2019年的多中心回顾性研究则发现,MWA治疗80岁以上老年早期肺癌患者的5年局部控制率为63.9%。Wang等的对照研究进一步发现,肺叶切除与MWA治疗的2年无疾病生存率分别是75.29%和76.09%,尽管在该研究中两种治疗的预后相仿,但MWA的治疗花费明显低于肺叶切除。 AHC是通过高压氩气使组织迅速降温至–140℃,再通过氦气使组织升温到20℃~40℃,温度变化使得靶组织蛋白质变性、细胞裂解、组织缺血坏死等。AHC可以达到与MWA相当的消融范围,而且具有更好的保留细胞结构、对周围组织损伤小、操作过程中可清晰观察到消融边界等优点,其主要的缺点是操作时间相对较长。同RFA及MWA一样,AHC也推荐用于3 cm以内病灶的消融治疗。近年来关于冷冻治疗早期肺癌的研究也逐渐兴起。Yamauchi等对22例接受AHC治疗Ⅰ期肺癌患者进行回顾性研究,发现随访期内仅3%病灶出现进展,平均无进展时间为(69±2)个月,3年无疾病生存率67%。Moore等的研究结果显示AHC治疗Ⅰ期非小细胞肺癌的5年无进展生存率可达87.9%±9%。Zemlyak等的研究则对比了亚肺叶切除、RFA及AHC治疗早期肺癌的疗效,结果显示亚叶肺切除与AHC的3年肿瘤特异性生存率分别是90.6%和90.2%。以上研究提示经皮AHC治疗早期肺癌的局部复发率低,总生存率与亚肺叶切除相当。 目前,关于经皮消融治疗早期肺癌的研究越来越多,而且大多取得不亚于手术切除或SBRT的疗效。值得注意的是,在手术仍是早期肺癌主流治疗的大环境下,消融治疗的作用可能被低估。因为接受局部消融治疗的患者往往年龄更大、肺功能更差、体力活动状态(PS)评分更高。而这是消融治疗面临的普遍问题。一项单中心的回顾性研究较清晰地阐明了这种情况,该研究回顾性对比RFA、SBRT及亚肺叶切除治疗Ⅰ期肺癌患者的5年总生存率和无进展生存率,结果分别是RFA 58.9%和39.3%、SBRT 42.0%和34.9%、亚肺叶切除 85.5%和75.9%,而这明显的差距却在矫正了PS评分等因素后消失了。 GGN能否通过消融治疗达到根治?要回答这个问题需要明确以下两点:GGN型肺癌是否存在转移、能否当作局部疾病进行治疗?消融技术介入治疗GGN病灶能否达到根治? 有关GGN型肺癌的转移问题关键要看是否存在淋巴结转移,相关的研究数据报道较多。Zha等的一项纳入867例GGN型肺癌的研究显示,pGGN、CTR<0.5 mGGN、CTR 0.5~0.79 mGGN的淋巴结转移率分别为0%、6.9%、9.1%。而在Ye等的研究中,淋巴结转移率 pGGN为 0%、mGGN为 2.2%,均远低于实性结节的27%。一项回顾性研究纳入了581例GGN型肺癌,其中145例CTR≤0.5、最大径≤3 cm的GGN均未见淋巴结转移,而且该研究中27例0.5<CTR<1.0、最大径≤1 cm的GGN型肺癌也未见淋巴结转移。综合大量的研究数据可发现,pGGN均未见淋巴结转移,CTR≤0.5或最大径<1 cm的mGGN淋巴结转移率极低,而CTR>0.5或最大径>1 cm的mGGN淋巴结转移率也明显低于实性结节。从病理角度,AIS和MIA阶段没有淋巴结转移,即便是IAC,如果CTR≤0.5也极少有淋巴结转移。另外,GGN型肺癌未见远处转移的报道,不少专家提出GGN型肺癌无需行头颅磁共振成像(MRI)、骨扫描、支气管镜等检查评估。综上,绝大多数GGN型肺癌属于无转移的、可经局部治疗治愈的局部病变,提示局部消融治疗有根治该类疾病的可能性。 那么,消融治疗GGN病灶能否达到根治呢?消融治疗在早期肺癌中的成功应用,也促进了它在这一特殊类型早期肺癌中的探索。GGN型肺癌属于3 cm以内早期肺癌或原位癌,理论上看可根治实性早期肺癌的消融技术也完全有可能根治GGN型肺癌。尽管目前消融技术根治GGN的报道并不多,但均取得了令人满意的结果。Kodama等的回顾性研究发现,接受RFA治疗的42例GGN型肺癌患者中位随访时间42个月,5年总生存率和肿瘤特异性生存率分别为96.4%和100%。Iguchi等纳入16例GGN型肺癌患者进行RFA治疗,中位随访时间61.5个月,3年的病灶控制率达92.3%,且未发现严重并发症。我国的一项回顾性研究也观察到了RFA治疗GGN型肺癌的近期疗效,半年的病灶控制率100%。2018年一项回顾性多中心研究纳入了51例接受MWA治疗的GGN型肺腺癌患者,技术成功率100%,3年无局部进展生存为98%,3年肿瘤特异性生存率为96%,并发症均在可控范围。2020年也有一项回顾性研究报道了MWA在多发GGN中的应用,技术成功率100%,中位随访18个月未发现肿瘤复发,但该研究随访时间较短。2015年Kim等报道了1例AHC治疗5 mm pGGN的成功病例。2019年有一项小样本回顾性研究[101]纳入14例接受AHC治疗的GGN型肺癌,结果显示随访2年未见复发且无严重并发症。 以上研究结果为消融治疗GGN提供了初步的循证医学证据,提示通过消融技术介入根治GGN型肺癌是可行的,且操作安全。需要指出的是,这些临床研究的随访时间相对较短,病例数较少,尚缺乏大样本、前瞻性临床研究的数据。相信未来会有更多大样本、多中心、前瞻性、长随访的研究,以提供高级别循证医学证据。而且,虽然消融治疗有根治大部分GGN型肺癌的可能,但其无法进行淋巴结清扫或治疗,所以并不意味着消融治疗可以替代外科手术。本中心也对一些符合条件的GGN型肺癌病例进行了经皮消融治疗,积累了一定的经验,在临床中验证了GGN介入根治的可行性,典型病例见图2~4。 图3 CT引导经皮射频消融治疗磨玻璃结节典型病例 男,78岁,右肺下叶GGN经皮穿刺活检确诊腺癌,肾功能不全不宜外科手术;a:治疗前右肺下叶1.0 cm的mGGN;b:单极射频消融治疗GGN;c:射频消融治疗1个月后影像表现;d:射频消融治疗35个月后病灶仅残留纤维条索影 女,31岁,两肺多发GGN,右肺上叶mGGN经支气管镜活检确诊为腺癌,拒绝手术;a:治疗前右肺上叶1.6 cm的mGGN;b:氩氦刀冷冻消融治疗;c:冷冻治疗10 d后影像表现;d:氩氦刀术后18个月病灶吸收仅残留少许纤维条索影 作为外科手术的有力补充,消融技术介入根治的临床应用适应证有哪些?目前尚未发布针对GGN介入根治的临床指南,仅有国内今年发布的专家共识。该共识提出的GGN消融治疗适应证可供临床应用时参考,包括: 病理证实为AAH、AIS、MIA、IAC(排除远处转移)的周围型GGN,且存在因心肺功能差或高龄等因素无法耐受手术、术后出现新病灶无法耐受再次手术、拒绝手术、多发GGN、重度焦虑等; 拒绝活检及手术的患者如有影像学恶性征象或极度焦虑,在多学科会诊的基础上与患者共同决策确定是否“可不取病理直接消融或消融与活检同步进行。”总之,鉴于目前尚缺乏高级别循证医学证据及权威指南的推荐,消融治疗应严格掌握适应证,只针对不能耐受或不愿意外科手术的患者,作为外科手术的补充。 我们结合10余年来经皮介入消融的经验,提出以下补充建议: GGN的非手术活检不能准确判断肿瘤的浸润程度,活检的病理分型只能作参考,但一般不会影响适应证的选择。 无病理确诊GGN的消融治疗适应证除了拒绝活检及手术外,还应包括经评估非手术活检难以取到合格标本或出血风险大的患者,如1 cm以内的pGGN、中间有大血管的GGN等。 选择消融治疗时必须先评估病灶所在位置对消融疗效的影响,为确保根治,病灶必须位于治疗针易于到达且周围无心脏、大血管的部位。 不能耐受手术主要包括高龄或有严重并存病、多发结节、近肺门区结节等,注意不宜手术是相对的,外科、内科、介入科医生的看法可能存在较大的差异;不愿意手术必须以经充分说明后患者及家属仍签字拒绝手术为准。 对病理未确诊的GGN,考虑到pGGN活检的病理结果准确性较差且活检后出血较明显,宜不取病理直接消融;消融同步活检主要应用于病理未确诊的mGGN,活检可在消融前、消融中或消融后进行。对血管丰富的病灶,建议采用热消融如微波或射频,且消融中进行活检为佳,有助于减少活检后出血且不影响活检的病理结果;不建议在消融后活检,因有学者提出热消融造成的组织碳化可能会影响活检的病理检查结果。消融后活检主要应用于冷冻消融时,因冷冻不会影响活检标本的病理结果。 与外科手术一样,确定消融治疗的时机需要充分考虑GGN生长规律及侵袭性。GGN型肺癌呈惰性生长,治疗时间窗很宽,为避免过度治疗,必须是经过一段时间的随访后高度怀疑为浸润性病变、或随访中病灶增大或实性成分增多时才考虑消融介入根治。另外,对十分焦虑的患者在考虑消融治疗时可积极些,对预计生存期有限的高龄或有严重并存病患者,必须在充分衡量得失后确定是否消融。消融介入治疗能否达到根治,也与操作者的操作技术及临床经验密切相关。建议MWA、RFA采取低功率、较长时间的治疗策略,确保消融后磨玻璃影大于病灶10 mm以上;氩氦刀冷冻治疗尽量采用多针适型,分2~3个循环、冷冻总时间不短于30 min,确保冷冻消融治疗中病灶位于–40℃范围内。 相较于外科手术,经皮消融介入根治GGN具有操作快速、创伤小、安全性高、费用低,对肺组织损伤轻、可多次操作,对无病理诊断者可同步活检等优点。但也存在对操作技术要求高、消融治疗参数个体差异大、质量控制要求高、较难同质化、不能百分之百确保根治等缺点。目前经皮消融根治GGN是可行的,临床主要用于不宜或不愿手术的GGN型早期肺腺癌或病理未确诊但高危的GGN。鉴于pGGN及绝大多数mGGN属于没有转移的局部疾病,未来经皮消融治疗有望成为这类患者除了外科手术以外的主要治疗手段,根据病灶特点、病灶部位及患者情况等个体化选择治疗方法。 此外,气道内超声及电磁、虚拟导航技术的快速发展使经支气管消融治疗GGN成为可能。近年来,导航技术及超声引导下插入RFA、MWA软性探头消融治疗恶性肺结节已在不断探索中,带有水微循环的经支气管镜软性消融探头也已研发成功,拓展了消融治疗范围。目前为数不多的单中心小样本的研究也初步证实了支气管镜下消融疗效确切。但该技术仍存在许多问题: 消融探头难以经病灶中间到达病灶远端,消融范围难以确保超过病灶边缘10 mm以上。 探头只能经支气管到达病灶,只能应用于消融探头能够到达的与支气管相通的病灶;支气管镜下经肺实质结节抵达术(BTPNA)可使消融电极不经支气管到达病灶部位,但该技术存在操作难度大、创伤较大、费用高、费时长等缺点。 消融治疗功率不稳定,且没有标准的消融治疗参数可供参考,影响了消融效果及该技术的普及。 设备昂贵、消融探头没有取得管理部门批准,目前只能临床科研中应用。总之,作为肺结节消融治疗的新技术,经支气管消融技术目前可探索性的应用于治疗肺功能差、经皮穿刺气胸或出血风险大的恶性GGN或实性结节。随着治疗探头更加精细、输出功率更加稳定以及BTPNA的改进、应用经验的累积,该技术将逐渐成熟,有望扩大适应证及提高根治的可能性。 一、磨玻璃结节再认识
1、磨玻璃结节的影像特征与病理的关系

2、磨玻璃结节的生长规律
二、磨玻璃结节的处理策略
1、随访观察

2、非手术活检的进展
有关非手术活检,必须注意以下几点:
3、治疗进展
三、磨玻璃结节的消融治疗
1、经皮消融技术在早期肺癌中的应用
2、消融技术介入根治GGN的可行性


3、磨玻璃结节消融治疗的临床实践