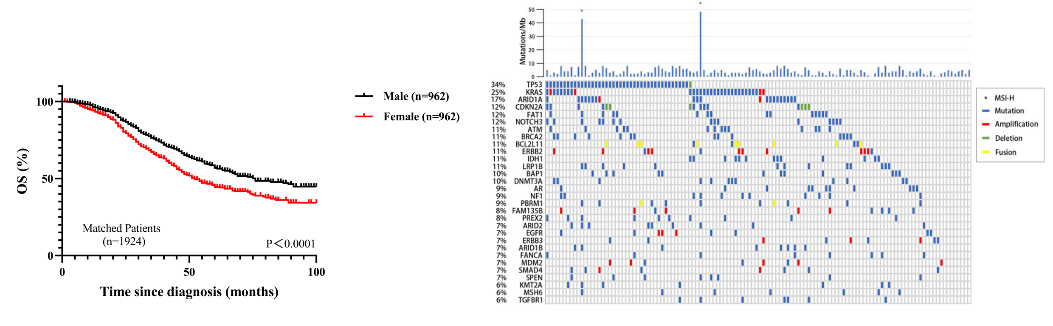
近日,中山大学附属第一医院肝胆胰外科中心匡铭教授团队在北美肝病学会会刊Hepatology杂志上发表肝癌消融领域的最新研究成果。 该研究创新性地在RNA表观遗传修饰层面探讨不全消融后肝细胞癌(HCC)复发转移的调控新机制,为防治不全消融后HCC的复发转移提供了新的干预方向。
近年来,随着肝癌检查手段的更新优化及定期随访方案的推广,小肝癌的诊出率逐年提高。欧洲肝病学会、北美肝病学会和亚太肝病学会的肝癌治疗指南均将射频消融(Radiofrequency ablation,RFA)与手术切除、肝脏移植同列为直径≤3cm 肝癌的根治性治疗方法。小肝癌诊出率的持续增加及 RFA 在肝癌治疗中优先级的提高使得肝癌 RFA 治疗数量近年大幅提升。
在我国,射频消融因其创伤小、重复性好、住院时间短等优点而备受重视。尽管射频消融已成为目前治疗 HCC 最重要的手段之一。
然而与手术切除相比,射频消融复发率更高,无瘤生存期较短,限制了 RFA 在3cm以上肝细胞癌治疗中的应用。这一现象对 RFA 的临床应用提出了挑战。直至目前,仍无有效手段防治肝癌治疗后高复发转移。
为预防RFA后肝癌复发,进一步提高消融临床疗效,中山大学附属第一医院肝胆胰外科中心匡铭教授团队以“表观遗传修饰与细胞应激调控”为突破口,深入挖掘肝癌细胞在不全射频消融产生的亚致死性热刺激条件下,通过动态可逆的m6A表观遗传修饰快速调控应激相关基因翻译的分子机制。
近日,相关研究成果以题名为“Insufficient Radiofrequency Ablation Promotes Hepatocellular Carcinoma Metastasis through m6A mRNA Methylation Dependent Mechanism”发表在北美肝病学会会刊Hepatology杂志上。

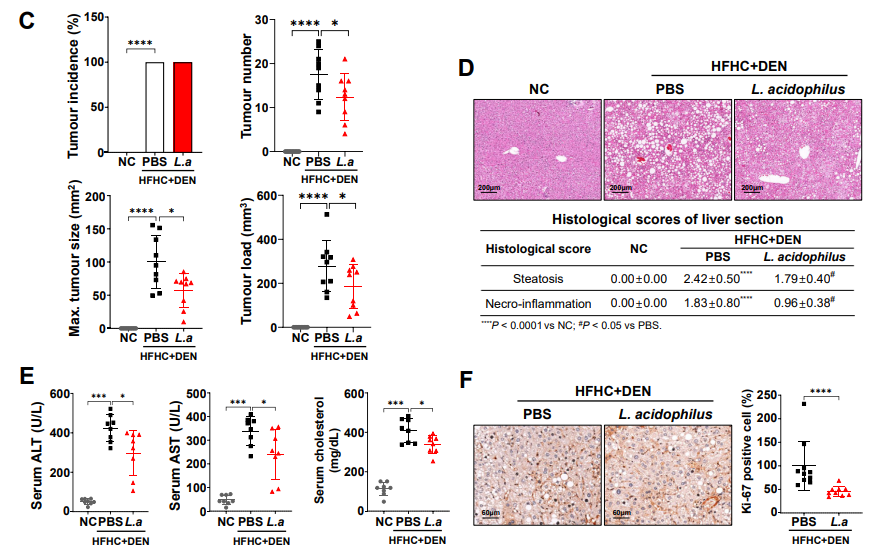
研究结果发现在亚致死性热刺激作用下的消融过渡区,m6A修饰识别蛋白YTHDF1的蛋白水平明显上调,而其他介导m6A修饰的关键因子水平则无明显变化。此外,亚致死性热刺激显著上调HCC细胞的m6A修饰水平。
体外功能实验发现在亚致死性热刺激条件下,YTHDF1可促进HCC细胞的生长、侵袭及转移,而在小鼠尾静脉肺转移模型及肝包膜下注射的原位HCC模型中则发现敲除YTHDF1可显著减少由亚致死性热刺激引起的HCC肺转移。
▲亚致死性热刺激通过m6A-YTHDF1信号轴调控肝癌消融后复发机制图
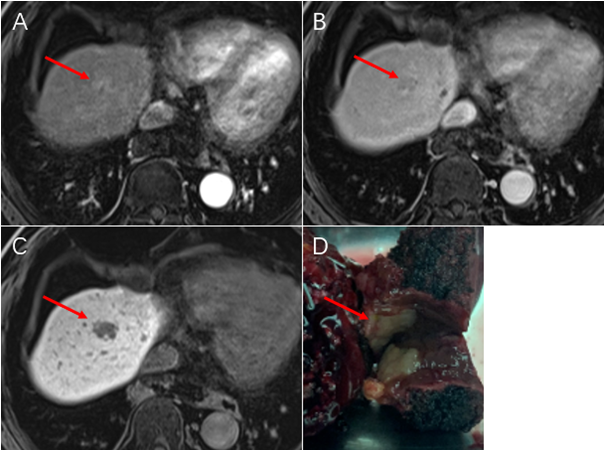
进一步机制研究发现,亚致死性热刺激上调表皮生长因子受体EGFR mRNA 5’UTR的m6A修饰水平,进而促进YTHDF1与癌基因EGFR的mRNA结合并上调其蛋白表达水平,导致RFA后HCC的复发转移。EGFR蛋白水平的增加在PDX小鼠HCC消融模型和消融患者的HCC组织中均得到验证。
最后,该研究证实了联合阻断YTHDF1及EGFR可协同抑制亚致死性热刺激后HCC细胞的恶性行为。该研究通过亚致死性热刺激细胞模型、原位移植HCC小鼠消融模型、PDX小鼠消融模型以及尾静脉肺转移小鼠模型,并结合多种翻译组学技术,为RFA后HCC进展相关机制的探讨提供了系统性工具和方案。
匡铭教授团队首次报道了m6A表观遗传修饰参与了RFA后HCC复发转移的调控,并进一步阐明了m6A-YTHDF1-EGFR信号轴促进RFA后HCC复发转移的机制,为靶向干预表观遗传机制来预防消融后HCC复发提供了科学依据。
匡铭教授指导的博士生苏天洪是该论文的第一作者,附属第一医院消化内科博士生黄曼玲和肝胆胰外科中心博士廖俊彬是文章的共同第一作者,附属第一医院肝胆胰外科中心及肿瘤中心主任匡铭教授是文章的最后通讯作者。本研究是匡铭教授团队在肝癌消融领域的又一次突破。