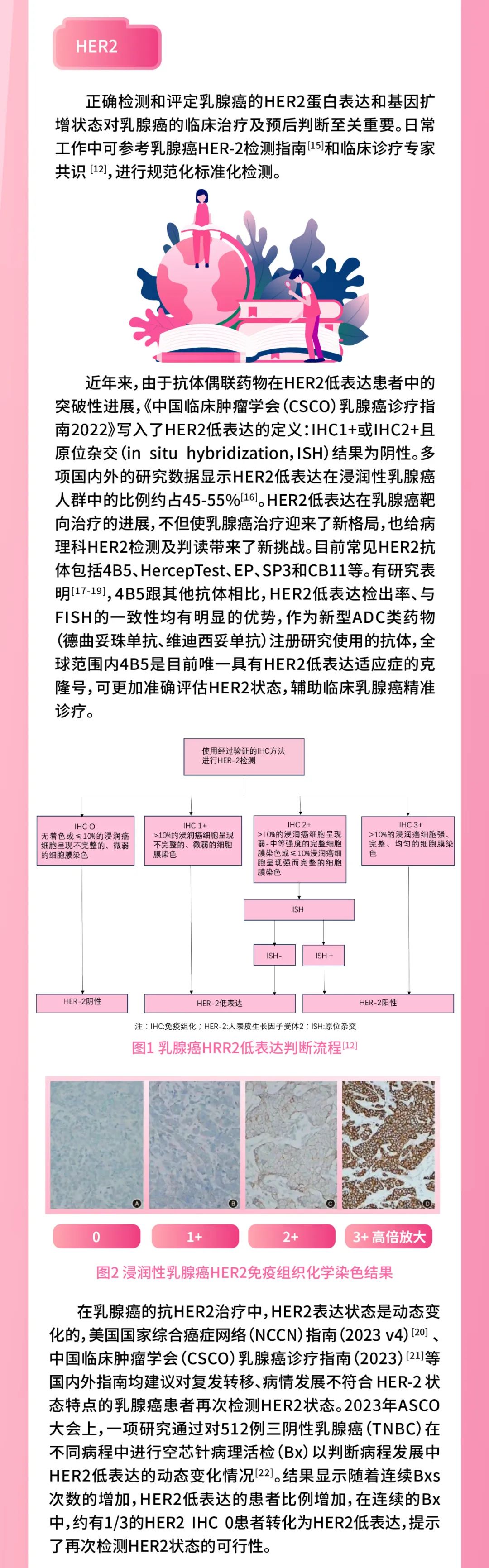
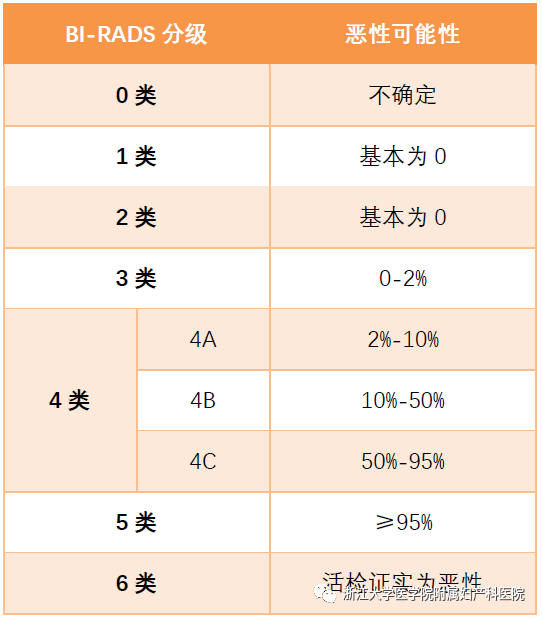
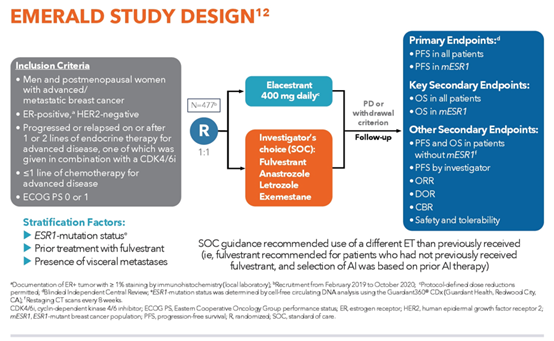
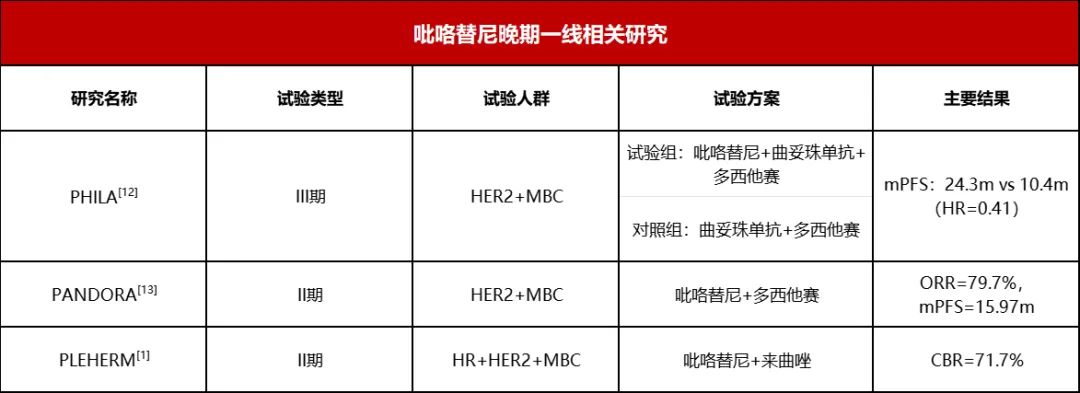
本期科技能见度的主题就与乳腺癌的“土壤改造”革命有关。许多人知道,明星陈晓旭、阿桑、姚贝娜等都是被乳腺癌夺去了生命。最新的《中国肿瘤登记年报》也显示,乳腺癌的发病率已位居女性恶性肿瘤首位,每年新发病例约27.9万。
面对这一凶狠的“健康杀手”,人们真的不能逆袭吗?
对此,中山大学孙逸仙纪念医院乳腺肿瘤中心学科带头人宋尔卫教授团队跳出常规思维,将目光锁定在乳腺癌的微环境上。
近十年来,他们都在关注乳腺癌肿瘤与肿瘤微环境的关系,并将此比作“种子”与“土壤”。他们率先提出,乳腺癌保乳手术后可将剩余的乳腺癌“土壤”进行“改造”,使之成为抗癌免疫细胞的“生产基地”。
与之相关的创新研究成果频频登上国际顶尖杂志《细胞》《癌细胞》《自然·免疫》《科学·转化医学》……今年10月,宋尔卫团队又在国际顶尖杂志《细胞》刊发了针对乳腺癌微环境的最新研究文章——他们发现了好细胞“叛变”的机制,也提出了对战乳腺癌的“土壤改造”新招式。
此刻,就让我们一起去探秘这最新的乳腺癌免疫治疗“新战术”吧。

如今,肿瘤免疫治疗成为大热。因为人们渐渐发现,狡猾的肿瘤细胞通常会“跑”,比如会发生远处转移。免疫治疗则是发动全身的免疫细胞来一场“大巡察”,识别并进攻全身的肿瘤细胞,使它们无容身之所。
然而在100多年前,医生与乳腺癌过招的办法,在如今看起来有些简单粗暴。当时最主流的观点认为,乳腺癌发生时只是局部疾病,切了就根治了。
19世纪中期,德国医学家鲁道夫·菲尔绍(Rudolf Virchow)提出理论指出,乳腺癌源于乳腺上皮细胞,并沿筋膜及淋巴管扩散。不过,它可被区域淋巴结有效阻挡。因此,乳腺癌一开始只是局部疾病,发展到一定程度才发生全身转移。美国著名外科医生威廉姆·哈尔斯蒂(William Halsted)是这一想法的“铁粉”。他认为,在乳腺癌处于局部疾病期时,若完整切除肿瘤及相应区域淋巴结,就能安全治愈。
再后来,乳腺癌根治术的手术范围一直在扩大,甚至出现“扩大根治”或“超级根治”等手术方式。但由于其手术创伤巨大,并发症多且严重,且并没有带来良好的生存获益,很快就被人们所摒弃。
随后放疗、化疗兴起。缩小乳房手术范围加放疗、化疗等综合治疗渐渐流行起来。美国匹兹堡大学的外科医生费舍尔(Fisher)提出了一种“叫板”威廉姆·哈尔斯蒂的观点。他认为,肿瘤的播散是无序的,在早期即可通过血液播散至全身,是系统性疾病,并证实了这一说法的正确性。费舍尔等外科专家,随后开启了乳腺癌外科治疗历史上的一次重大革命——保乳术。
保乳术加针对残余肿瘤细胞的辅助治疗(放、化疗)这一方案,于1970年开始流行,影响力持续至今。20世纪90年代后,保乳术被美国国立卫生研究院(NIH)确定为早期乳腺癌的标准治疗方案。
改造“土壤”
21世纪,精准治疗时代来临。过去10年,随着基因组学和分子生物学的发展,人们对乳腺癌有了更深入的了解。
人们开始知道乳腺癌不同的分子分型。这相当于给乳腺癌打上不同的标签,针对不同种类采取不同治疗方法,效果也不尽相同。
然而,并非所有患者能受益。不少患者出现对药物不敏感,或者是在治疗过程中出现耐药等情况,导致治疗无效。
疗效不好就无计可施了吗?能否换种思路?
这些年,宋尔卫团队另辟蹊径,想到从乳腺癌肿瘤的微环境入手。他们喜欢将乳腺癌肿瘤与肿瘤微环境比作“种子”与“土壤”。“100多年前的主流是全切根治术,随后,保乳手术加针对残余肿瘤细胞的辅助治疗登上历史舞台。
这些治疗更多针对的都是‘种子’。我们大胆设想,从‘土壤’入手治疗,通过保乳手术加优化肿瘤微环境的方式,将‘土壤’变成抗癌免疫细胞的‘生产基地’,从而达到治疗患者的目的。”宋尔卫告诉南方+记者,近十年来,他们的研究重点之一就是如何进行“土壤改造”。
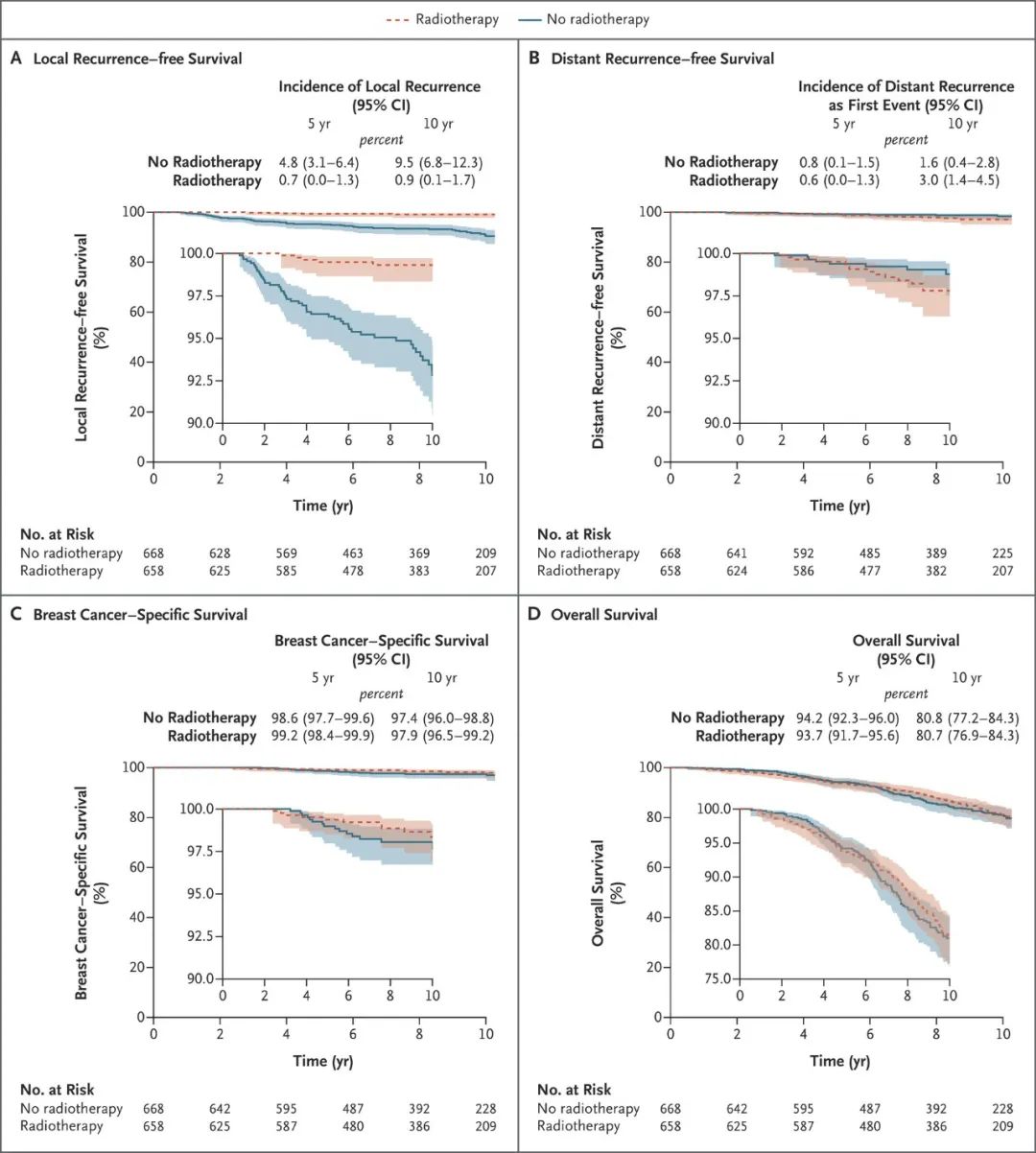
这并非突发奇想。2016年《柳叶刀肿瘤学》杂志的一篇报道指出,早期乳腺癌患者保乳术后加上放疗与全乳切除相比,10年生存期更长;宋尔卫团队还回顾分析了2000多例保乳术的患者,他们与同期接受乳房全切术的患者比较,不少生存指标更具优势。
“可见,保乳手术留下的肿瘤‘土壤’大有学问,要好好利用。”宋尔卫团队还考虑到另一个层面的问题,放、化疗这些传统的辅助治疗方法或是一柄“双刃剑”:一方面,放化疗导致的肿瘤细胞死亡,可诱发机体内在的免疫反应以杀死全身残余癌细胞;另一方面,辅助治疗不当,可能引起过度的炎症反应,让肿瘤躲过免疫系统的攻击,甚至恶化。
“惩恶扬善”
今年,宋尔卫团队在国际顶尖杂志《细胞》上发表的两篇文章,都是围绕“土壤改造”展开的。
其一瞄准了“土壤”中的“成纤维细胞”。研究发现,肿瘤微环境由大量间质细胞和非细胞成分组成。“成纤维细胞”是肿瘤间质中“人员数量”最多的。但对人体来说,科学家不清楚它到底是“好人”还是“坏人”。
经过近10年研究,宋尔卫团队发现,蛋白CD10和GPR77可作为“成纤维细胞”是“忠”还是“奸”的身份标签,因为具有这两种标签的“成纤维细胞”越多,乳腺癌病人对化疗的敏感性就越差。
背后的原因是什么呢?研究者发现,这些邪恶的“成纤维细胞”,会分泌细胞因子“IL-6、IL-8”,它们会维持肿瘤干细胞的特性,“助纣为虐”,导致肿瘤对化疗的耐药。
在小鼠模型中,研究者使用了GPR77的阻断抗体,再联合化疗。他们发现这比单纯化疗的效果好,肿瘤缩小明显。
这篇文章给医学界一个重大启示:瞄准肿瘤“土壤”中的“成纤维细胞”,可有效改善化疗耐药的状况,增强治疗效果。
同样被《细胞》关注的另一项研究结果,在今年10月新鲜出炉,研究瞄准了巨噬细胞。这一细胞是免疫细胞的一种,它有一张“大嘴巴”,可以吞噬“元凶”肿瘤细胞。
宋尔卫介绍,有一类乳腺癌会表达出“HER2阳性”标记,“HER2阳性”的患者约占乳腺癌患者的30%。这部分患者运气不是很好,她们复发概率高、预后差。针对“HER2阳性”标记,一种被称为“赫赛汀”的药是它的靶向治疗药物。但仍有一部分患者治疗效果不好,容易耐药。
这背后的原因是什么?
宋尔卫、刘强教授及其团队展开了研究。
他们此前已了解到,“赫赛汀”在与“HER2阳性”的肿瘤细胞结合后,还会牵手“NK细胞”,并让“NK细胞”杀伤肿瘤细胞;此外,“赫赛汀”还可与巨噬细胞“结盟”,吞噬肿瘤细胞。这种吞噬有一个名字:叫抗体依赖细胞吞噬效应(ADCP)。
但ADCP的作用机制一直不清晰。为了解这一机制,研究人员研究后惊喜地发现,当“HER2阳性”的患者用了“赫赛汀”后,那些吞噬了肿瘤细胞的巨噬细胞,竟然会摇身一变,叛逃成为肿瘤细胞的“内奸”。它们会“派出”免疫抑制分子“代号”为PD-L1和IDO。这两大“作恶分子”的本领是,使能杀伤肿瘤的T细胞以及NK细胞“罢工”,让肿瘤细胞躲过免疫系统的“致命追击”。
科学家们开始对小鼠做实验,发现通过去除巨噬细胞,可以明显增强“赫赛汀”的治疗效果。但一个现实情况是,巨噬细胞是人体的免疫细胞,不可能被去除。
针对“叛变”的巨噬细胞“培养”出的“作恶分子”PD-L1和IDO,科学家们调整战术,针锋相对,利用免疫节点抑制剂进行治疗,阻断其与T细胞、NK细胞“结盟”。这样,“作恶分子”便不能“下黑手”,肿瘤“元凶”也就无处可逃了。
历经百余年科技发展,在保乳术后,精准采取抗肿瘤的免疫主导治疗,有可能从根本上改善乳腺癌患者的治疗效果。
或许,免疫治疗“唱主角”的乳腺癌治疗时代快要来临了。
(感谢中山大学孙逸仙纪念医院黄迪、林伟吟老师对本文的贡献)
转自广东健康头条